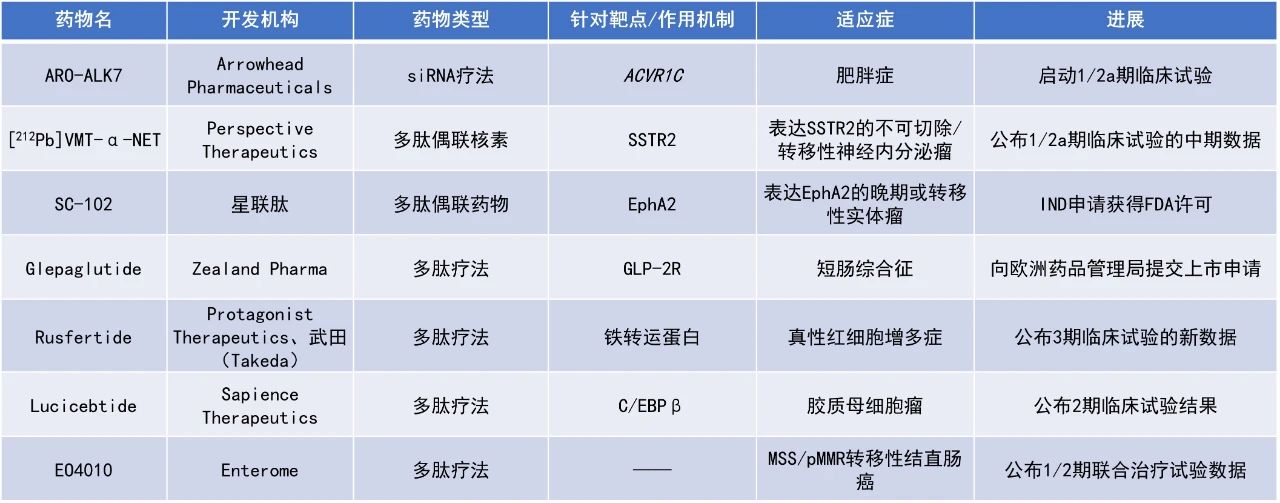
Glepaglutide:向EMA提交上市申請
Zealand Pharma公司宣布向EMA遞交其長效胰高血糖素樣肽-2(GLP-2)類似物glepaglutide的上市許可申請(MAA),用于治療SBS成人患者。Glepaglutide是一種裝于自動注射器中的液體產品,設計用于每周兩次的皮下給藥,旨在減少或消除SBS患者對腸外營養支持(PS)的需求。美國FDA已授予該療法治療SBS的孤兒藥資格。
該遞交主要是基于隨機雙盲關鍵3期試驗EASE-1的結果,并得到兩項正在進行的長期擴展試驗EASE-2和EASE-3的中期結果和機制試驗EASE-4的結果支持。EASE-1研究中,與安慰劑相比,每周兩次glepaglutide給藥在第24周顯著降低患者每周PS所需總液體體積(P=0.0039)。第24周時,每周兩次接受glepaglutide治療患者的PS液體體積較基線平均降低5.13公升/周。安慰劑治療僅導致所需PS液體體積降低2.85公升/周。對于接受每周兩次glepaglutide治療的患者,14%的患者(n=5)實現不再需要PS輔助治療,而安慰劑治療患者均不能停用PS。
Rusfertide:公布3期臨床試驗的新數據
Protagonist Therapeutics公司與武田(Takeda)公布了3期研究VERIFY的積極新結果。該試驗主要評估每周一次的rusfertide自我給藥皮下注射,在那些標準治療下仍血容量控制不佳且依賴放血療法的真性紅細胞增多癥患者中的療效與安全性。Rusfertide是一種潛在“first-in-class”的在研天然激素鐵調素的多肽模擬物,已獲得美國FDA的孤兒藥資格和快速通道資格。
此次公布的分析結果顯示,該研究達到了其主要終點,rusfertide聯合當前標準治療在高危和低危PV患者中使臨床緩解率較安慰劑聯合當前標準治療組患者翻倍(76.9%對比32.9%),顯著降低需放血治療的患者比例。所有關鍵次要終點也均達到統計學顯著差異,包括rusfertide聯合治療組需放血治療的患者比例顯著下降(27%對比78%),保持血細胞比容水平低于45%的患者比例顯著提升(62.6%對比14.4%),患者報告的結局也有所改善。此外,未報告任何與rusfertide相關的嚴重不良事件。
EO4010:公布1/2期聯合治療試驗數據
Enterome公司公布了其在研免疫療法EO4010的1/2期臨床試驗AUDREY的積極數據。該研究旨在評估EO4010聯合納武利尤單抗(nivolumab)±貝伐珠單抗(bevacizumab)治療微衛星穩定(MSS)/錯配修復功能正常(pMMR)轉移性結直腸癌(mCRC)的效果。EO4010是一種由五種微生物衍生肽組成的疫苗,這些肽模擬了五種常見于結直腸癌患者的腫瘤相關抗原(TAA)——BIRC5、FOXM1、UBE2C、CDC20和KIF2C,旨在激活患者的腫瘤特異性CD8陽性T細胞,引導其識別并殺死表達這些抗原的癌細胞。
此次公布的結果顯示,EO4010顯示出良好的安全性和耐受性。中位隨訪時間為15.4個月時,20名MSS/pMMR mCRC患者的12個月生存率為40%,中位生存時間為11.3個月。目前,患者的生存曲線已趨于平穩,34%(7/20)的患者仍存活。此外,80%接受EO4010聯合納武利尤單抗治療的患者體內檢測到針對腫瘤相關抗原的特異性免疫反應。這些積極結果支持進一步開發EO4010治療結直腸癌的潛力。
Lucicebtide:公布2期臨床試驗結果
Sapience Therapeutics公司公布了其潛在“first-in-class”的C/EBPβ拮抗劑lucicebtide治療膠質母細胞瘤的2期臨床試驗數據。Lucicebtide已獲得美國FDA授予用于治療復發性GBM的快速通道資格,以及美國FDA和歐盟委員會授予的孤兒藥資格,用以治療神經膠質瘤。
此次公布的結果顯示,lucicebtide作為單一療法和與標準護理(SoC)聯合使用具有良好的耐受性。截至2025年5月6日的數據,新確診的GBM隊列中,9名患者中有5名尚未出現疾病進展(10-24+個月),6名患者在數據截止時仍然存活;復發性GBM隊列中,9名患者中有4名獲得疾病控制,其中2名為部分緩解(PR),3名患者在數據截止時仍然存活。
[212Pb]VMT-α-NET:公布1/2a期臨床試驗的中期數據
Perspective Therapeutics公司公布了其候選多肽偶聯核素療法[212Pb]VMT-α-NET的1/2a期臨床試驗的最新中期數據。該研究旨在評估[212Pb]VMT-α-NET在表達SSTR2的不可切除/轉移性神經內分泌瘤(NET)患者中的療效和安全性,這些患者既往未接受過放射性藥物治療(RPT),并且放射學證據顯示其腫瘤在入組前12個月內已發生疾病進展。
四川省醫藥保化品質量管理協會組織召開
2025版《中國藥典》將于2025年10月..關于舉辦四川省藥品生產企業擬新任質量
各相關企業: 新修訂的《中華人..四川省醫藥保化品質量管理協會召開第七
四川省醫藥保化品質量管理協會第七..“兩新聯萬家,黨建助振興”甘孜行活動
為深入貫徹落實省委兩新工委、省市..學習傳達中央八項規定精神專題會議
2025年4月22日,協會黨支部組織召..關于收取2025年度會費的通知
各會員單位: 在過去的一年里,..四川省應對新型冠狀病毒肺炎疫情應急指
四川省應對新型冠狀病毒肺炎疫情應..四川省應對新型冠狀病毒肺炎疫情應急指
四川省應對新型冠狀病毒肺炎疫情應..