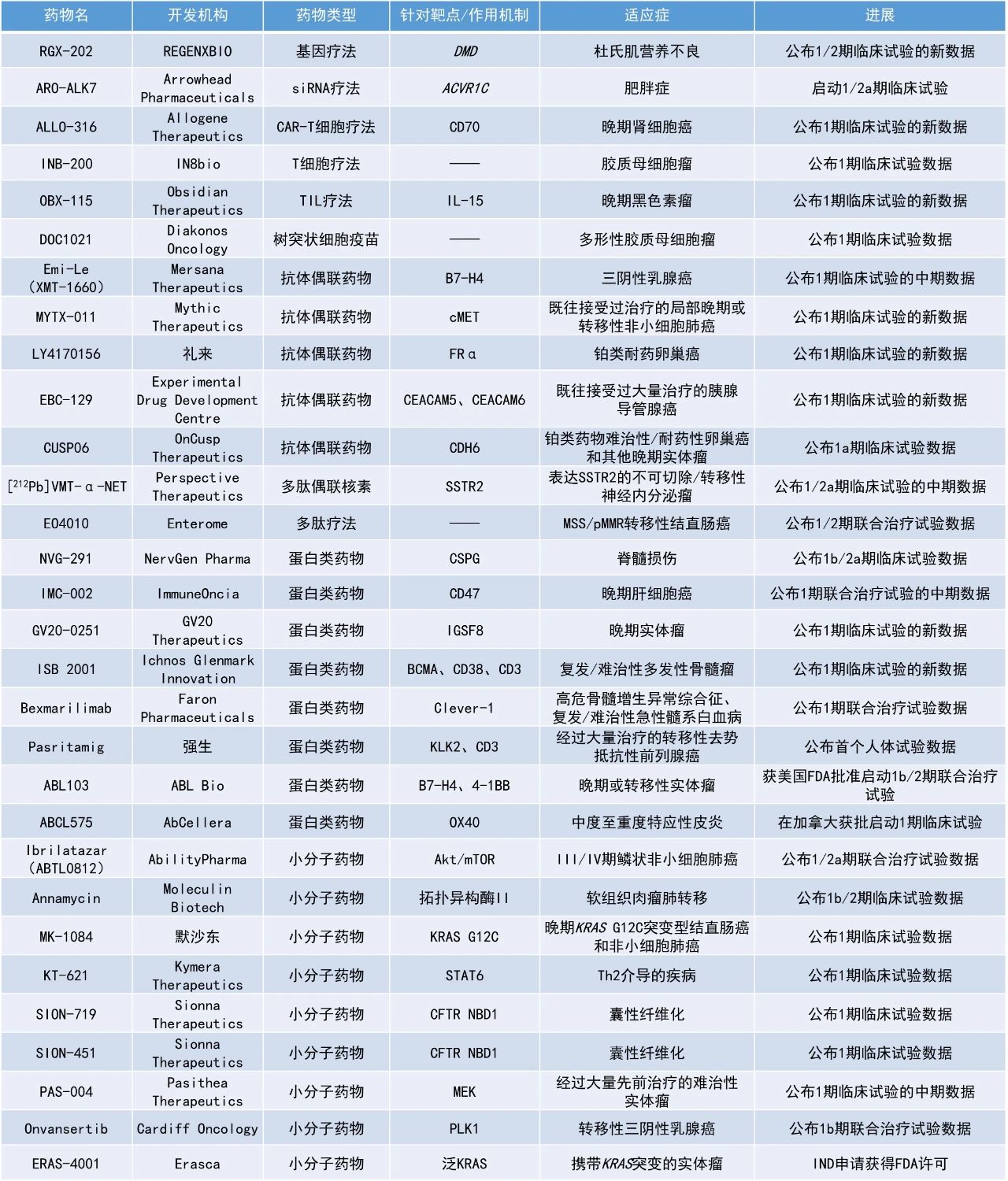
本期看點
Bexmarilimab:公布1期聯(lián)合治療試驗數(shù)據(jù)
Faron Pharmaceuticals公司宣布,其靶向Clever-1的單克隆抗體bexmarilimab的一項1期研究結(jié)果已發(fā)表在《柳葉刀-血液學(xué)》(Lancet Haematology)雜志上。該研究旨在評估bexmarilimab聯(lián)合SoC治療高危骨髓增生異常綜合征和復(fù)發(fā)/難治性(r/r)急性髓系白血病(AML)患者的安全性和有效性。Bexmarilimab是Faron公司全資擁有的研究性免疫療法,旨在通過靶向髓系細胞功能和激活免疫系統(tǒng),克服對現(xiàn)有療法的耐藥性并優(yōu)化臨床療效。Bexmarilimab能與巨噬細胞上的免疫抑制受體Clever-1結(jié)合,該受體有助于腫瘤生長和轉(zhuǎn)移(即幫助癌癥躲避免疫系統(tǒng))。通過靶向巨噬細胞上的Clever-1受體,bexmarilimab可改變腫瘤微環(huán)境,將巨噬細胞從免疫抑制(M2)狀態(tài)重編程為免疫刺激(M1)狀態(tài),上調(diào)干擾素的產(chǎn)生,啟動免疫系統(tǒng)攻擊腫瘤,使癌細胞對標(biāo)準(zhǔn)治療敏感。
此次公布的結(jié)果顯示,bexmarilimab聯(lián)合阿扎胞苷在初治和低甲基化藥物(HMA)治療失敗的HR-MDS患者中的ORR分別為100%和89%。HMA治療失敗的MDS患者的估計中位OS為13.4個月,r/r AML患者為8.1個月。兩名HMA治療失敗的MDS患者在治療后接受了造血干細胞移植(HSCT)。此外,治療后患者的骨髓免疫生物標(biāo)志物較基線水平提升了近3倍。在67%的HMA治療失敗的MDS患者中觀察到HLA-DR分子增加,進一步支持bexmarilimab的作用機制。安全性方面,bexmarilimab聯(lián)合治療的耐受性良好,未觀察到劑量限制性毒性。大多數(shù)治療伴發(fā)不良事件(TEAE)為輕度至中度,僅6%與bexmarilimab相關(guān)。
Ibrilatazar(ABTL0812):公布1/2a期聯(lián)合治療試驗數(shù)據(jù)
AbilityPharma公司宣布,其評估ibrilatazar(ABTL0812)聯(lián)合化療(紫杉醇/卡鉑)治療III/IV期鱗狀非小細胞肺癌患者的1/2a期臨床試驗ENDOLUNG的數(shù)據(jù)已發(fā)表在Lung Cancer雜志上。Ibrilatazar是一種潛在“first-in-class”、差異化的口服靶向抗癌化合物,通過誘導(dǎo)內(nèi)質(zhì)網(wǎng)應(yīng)激和抑制PI3K/Akt/mTOR通路來引發(fā)自噬。在臨床試驗中,ibrilatazar對子宮內(nèi)膜癌和肺癌患者顯示出臨床益處。此外,它在包括肺癌、子宮內(nèi)膜癌、胰腺癌、神經(jīng)母細胞瘤和膠質(zhì)母細胞瘤等癌癥類型的動物模型中展示了強有力的臨床前概念驗證。
此次公布的結(jié)果顯示,與歷史對照相比,ibrilatazar聯(lián)合化療在所有療效終點均顯示出改善,包括:ibrilatazar聯(lián)合治療組的總緩解率為52%,歷史對照為31.7%;ibrilatazar聯(lián)合治療組的中位無進展生存期(PFS)為6.2個月,歷史對照為4.2個月;ibrilatazar聯(lián)合治療組的中位OS為22.5個月,歷史對照為11.3個月。安全性方面,ibrilatazar聯(lián)合化療表現(xiàn)出良好的安全性。在紫杉醇/卡鉑基礎(chǔ)上加入ibrilatazar的安全性與歷史對照中紫杉醇/卡鉑單獨使用時的安全性一致,并未帶來除紫杉醇/卡鉑本身已知不良事件之外的顯著新增安全性風(fēng)險。
KT-621:公布1期臨床試驗數(shù)據(jù)
Kymera Therapeutics公司公布其潛在“first-in-class”口服STAT6降解劑KT-621在1期健康受試者研究中的積極結(jié)果。數(shù)據(jù)顯示,KT-621在每日一次口服給藥下,于所有高于1.5 mg劑量水平中實現(xiàn)了超過90%的平均血液STAT6降解;在所有≥50 mg的MAD組中,更在血液與皮膚中均達成完全降解。此外,KT-621對Th2炎癥相關(guān)生物標(biāo)志物TARC和Eotaxin-3的中位降低幅度分別高達37%與63%,表現(xiàn)優(yōu)于或相當(dāng)于現(xiàn)有獲批藥物。
KT-621在本項試驗中展現(xiàn)出優(yōu)異的安全性,未觀察到嚴重不良事件或與治療相關(guān)的不良事件,整體耐受性與安慰劑無明顯差異。Kymera公司指出,KT-621的臨床表現(xiàn)已顯著優(yōu)于其預(yù)設(shè)的產(chǎn)品特征目標(biāo),進一步驗證了其“生物制品口服化”開發(fā)策略的可行性。當(dāng)前,KT-621正在中重度特應(yīng)性皮炎(AD)患者中開展1b期BroADen試驗,預(yù)計將在2025年第四季度公布數(shù)據(jù),并計劃分別于2025年第四季度與2026年第一季度啟動針對AD與哮喘的兩項2b期臨床研究。
ISB 2001:公布1期臨床試驗的新數(shù)據(jù)
Ichnos Glenmark Innovation公司公布了其三特異性抗體ISB 2001用于治療復(fù)發(fā)/難治性多發(fā)性骨髓瘤(RRMM)的1期研究的新數(shù)據(jù)。ISB 2001同時靶向多發(fā)性骨髓瘤(MM)細胞上的BCMA和CD38,以及T細胞上的CD3,旨在增加對MM細胞的特異性結(jié)合,同時最大限度地減少脫靶效應(yīng)。
此次公布的結(jié)果顯示,在經(jīng)過大量治療的患者群體中,7個活性劑量(≥50 μg/kg)組患者的持續(xù)總緩解率為79%,完全緩解/嚴格完全緩解(CR/sCR)率為30%。所有接受治療的患者的總緩解率為74%,包括2例接受較低劑量治療的患者。安全性方面,ISB 2001具有良好的安全性,大多數(shù)患者在數(shù)據(jù)截止時仍在接受治療。
四川省醫(yī)藥保化品質(zhì)量管理協(xié)會組織召開
2025版《中國藥典》將于2025年10月..關(guān)于舉辦四川省藥品生產(chǎn)企業(yè)擬新任質(zhì)量
各相關(guān)企業(yè): 新修訂的《中華人..四川省醫(yī)藥保化品質(zhì)量管理協(xié)會召開第七
四川省醫(yī)藥保化品質(zhì)量管理協(xié)會第七..“兩新聯(lián)萬家,黨建助振興”甘孜行活動
為深入貫徹落實省委兩新工委、省市..學(xué)習(xí)傳達中央八項規(guī)定精神專題會議
2025年4月22日,協(xié)會黨支部組織召..關(guān)于收取2025年度會費的通知
各會員單位: 在過去的一年里,..四川省應(yīng)對新型冠狀病毒肺炎疫情應(yīng)急指
四川省應(yīng)對新型冠狀病毒肺炎疫情應(yīng)..四川省應(yīng)對新型冠狀病毒肺炎疫情應(yīng)急指
四川省應(yīng)對新型冠狀病毒肺炎疫情應(yīng)..