本期看點
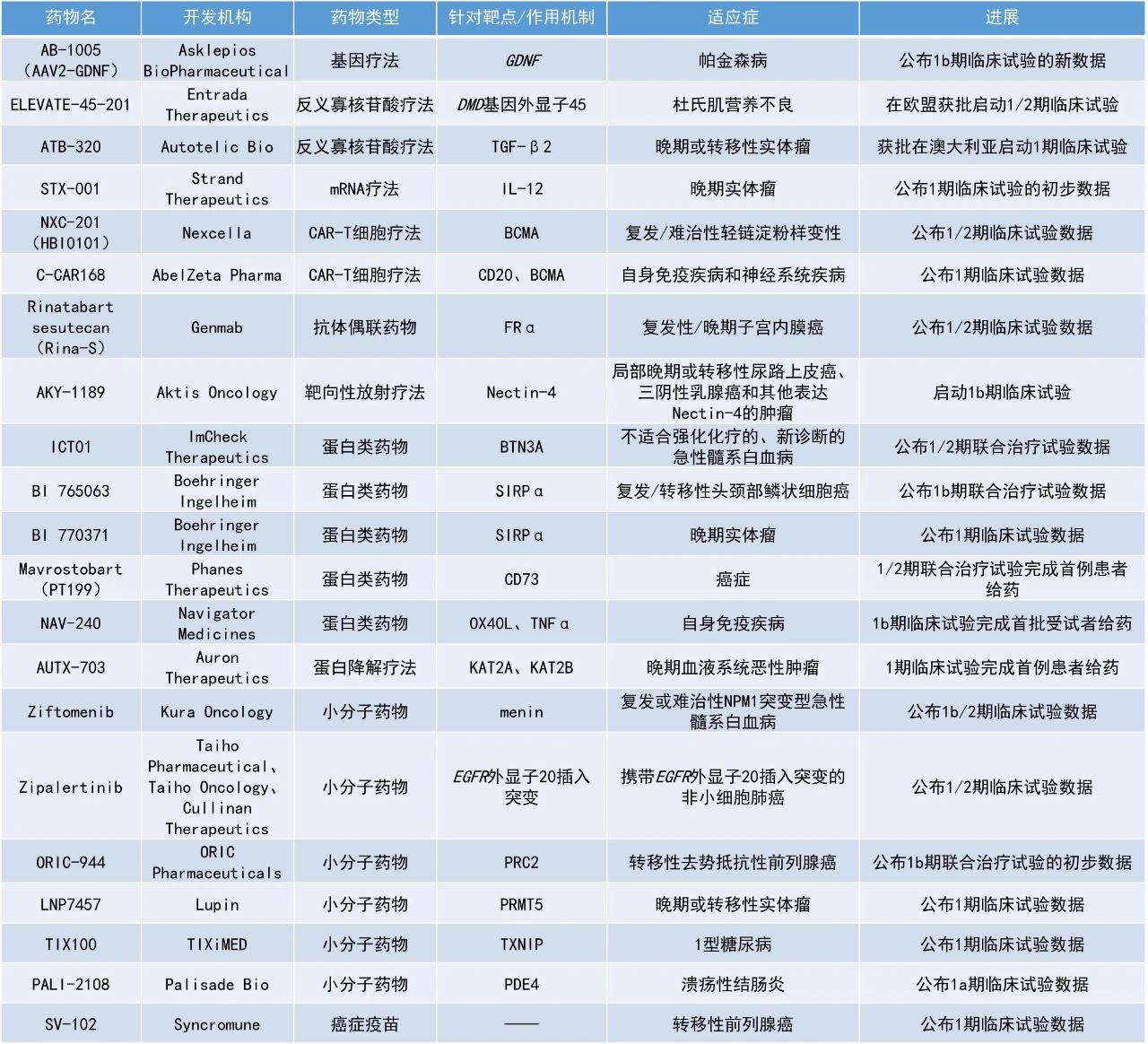
Rinatabart sesutecan:公布1/2期臨床試驗數據
Genmab公司日前披露旗下的候選療法rinatabart sesutecan(Rina-S)在1/2期試驗中,用以治療復發性/晚期子宮內膜癌患者中的療效結果。Rina-S是一種潛在“best-in-class”、葉酸受體α(FRα)靶向ADC,Genmab在去年4月收購普方生物(ProfoundBio)時獲得此款療法。
截至2024年11月22日,64例接受過大量既往治療的子宮內膜癌患者(中位3線,范圍1-8)接受了100 mg/m2(n=22)或120 mg/m2(n=42)劑量的Rina-S治療。在療效可評估患者中,中位治療持續時間為18.7周。分析顯示,接受低(n=22)與高(n=33)劑量患者的未確認ORR分別為50%與45.5%,其中低劑量組包含2例CR。低與高劑量組患者的DCR則分別為100%和81.8%。此外,在低與高劑量組中,分別有81.8%(9/11)與80.0%(12/15)患者持續緩解。安全性方面,最常見(>25%)的治療伴發不良事件(TEAE)在不同劑量下相似,主要是血細胞減少癥和1-2級胃腸道事件(惡心、嘔吐、食欲下降)。
ICT01:公布1/2期聯合治療試驗數據
ImCheck Therapeutics公司公布了其新型γ9δ2 T細胞激活劑ICT01聯用Aza-Ven治療不適合強化化療的新確診AML患者的積極1/2期臨床試驗數據。γ9δ2 T細胞是先天免疫系統的一部分,負責對腫瘤和感染的免疫監察。ICT01是一款靶向嗜乳脂蛋白家族成員BTN3A的單克隆抗體療法,通過與BTN3A結合,它可以選擇性地激活γ9δ2 T細胞,并且促進它們遷移和浸潤腫瘤,進一步激發CD8陽性T細胞和自然殺傷細胞的抗腫瘤反應。
截至2025年1月20日的數據,接受推薦劑量的ICT01聯合治療的患者的CRc率為96%,CR率為74%,且各種分子亞型的患者均有緩解。值得注意的是,具有不良或中等風險突變的患者通常對Aza-Ven治療應答較低,但接受三聯療法治療的患者實現了高緩解率,例如TP53突變AML患者的CR和CRc率分別達到了60%和83%。此外,接受10 mg ICT01治療的患者初步的9個月總生存率為83%。安全性方面,三聯療法在臨床上具有良好的可控性。
SV-102:公布1期臨床試驗數據
Syncromune公司公布了其個體化癌癥疫苗SV-102在mCRPC患者中的1期臨床試驗結果。數據表明,接受SV-102治療患者的ORR為87%,53%的患者達到了CR。安全性方面,SV-102耐受性良好,觀察到的TEAE多為低級別。
ORIC-944:公布1b期聯合治療試驗的初步數據
ORIC Pharmaceuticals公司公布了其選擇性PRC2別構抑制劑ORIC-944聯用雄激素受體(AR)抑制劑治療mCRPC的1b期臨床試驗的初步數據。截至2025年5月9日的數據,59%(10/17)的患者達到PSA50應答(即前列腺特異性抗原水平降低50%),確認的PSA50應答率為47%(1例待確認),24%(4/17)的患者達到確認的PSA90應答。在所有ORIC-944劑量水平中均觀察到PSA應答,目前大多數患者仍在繼續治療,其中多名患者的治療時間已接近一年或更長。安全性方面,ORIC-944與apalutamide或darolutamide聯合使用的耐受性普遍良好,絕大多數不良事件為1/2級,與PRC2和AR抑制一致。
STX-001:公布1期臨床試驗的初步數據
Strand Therapeutics公司公布了其自我復制mRNA療法STX-001用于治療晚期實體瘤的1期臨床試驗結果。STX-001是一種脂質納米顆粒封裝的自我復制mRNA藥物,可激活先天免疫系統,促進免疫原性癌細胞死亡,并表達IL-12以誘導針對腫瘤的免疫反應。在臨床前模型中,STX-001表現出顯著的免疫調節和抗腫瘤活性。
從2024年5月29日至數據截止日期(2024年12月16日),5名完成評估的黑色素瘤患者中,有3人的非注射病灶縮小(即遠隔效應),其中1例達到確認的CR,1例達到部分緩解(PR),1例靶病灶縮小100%,多個皮膚/內臟病灶出現顯著的炎癥反應。STX-001顯示出初步良好的療效、強烈的免疫激活作用以及可控的安全性。這些結果支持其作為單藥療法以及與免疫檢查點抑制劑聯合使用的進一步開發。
四川省醫藥保化品質量管理協會組織召開
2025版《中國藥典》將于2025年10月..關于舉辦四川省藥品生產企業擬新任質量
各相關企業: 新修訂的《中華人..四川省醫藥保化品質量管理協會召開第七
四川省醫藥保化品質量管理協會第七..“兩新聯萬家,黨建助振興”甘孜行活動
為深入貫徹落實省委兩新工委、省市..學習傳達中央八項規定精神專題會議
2025年4月22日,協會黨支部組織召..關于收取2025年度會費的通知
各會員單位: 在過去的一年里,..四川省應對新型冠狀病毒肺炎疫情應急指
四川省應對新型冠狀病毒肺炎疫情應..四川省應對新型冠狀病毒肺炎疫情應急指
四川省應對新型冠狀病毒肺炎疫情應..