5月23日,中國國家藥監局藥品審評中心(CDE)官網最新公示,信達生物1類新藥IBI363擬納入突破性治療品種,適應癥為經含鉑化療及抗PD-1/PD-L1免疫治療失敗的局部晚期或轉移性鱗狀非小細胞肺癌。IBI363是信達生物在研的一款PD-1/IL-2α-bias雙特異性抗體融合蛋白。針對本次擬納入突破性治療品種的適應癥,IBI363此前已經被美國FDA授予快速通道資格。
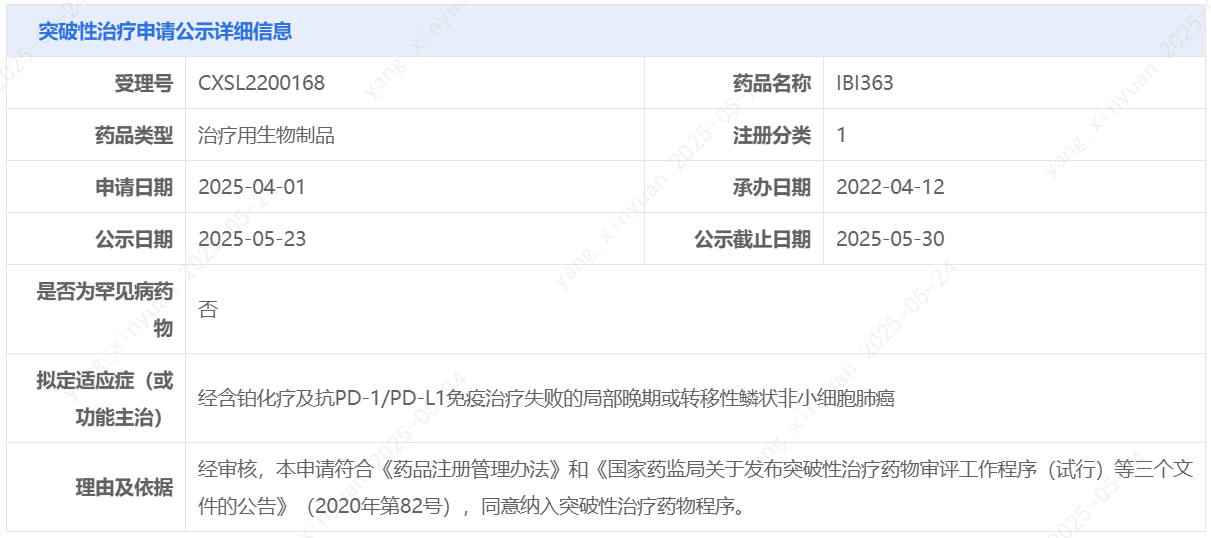
截圖來源:CDE官網
IBI363是由信達生物自主研發的PD-1/IL-2α-bias雙特異性抗體融合蛋白,同時具有阻斷PD-1/PD-L1通路和激活IL-2通路兩項功能。IBI363的IL-2臂經過了設計改造,保留了其對IL-2 Rα的親和力,但削弱了對IL-2Rβ和IL-2Rγ的結合能力,以此降低毒性;而PD-1結合臂可以同時實現對PD-1的阻斷和IL-2的選擇性遞送。由于新激活的腫瘤特異性T細胞同時表達PD-1和IL-2α,這一差異性策略可以更精確和有效地實現對該T細胞亞群的靶向和激活。IBI363不僅在多種荷瘤藥理學模型中展現出了良好抗腫瘤活性,在PD-1耐藥和轉移模型中也表現出了突出的抑瘤效力。
今年2月,信達生物宣布IBI363獲得FDA授予快速通道資格,擬定適應癥為抗PD-(L)1免疫檢查點抑制劑及含鉑化療治療后進展的局部晚期或轉移性鱗狀非小細胞肺癌。這也正是本次擬納入突破性治療品種的適應癥。
根據信達生物此前新聞稿,在2024年9月的世界肺癌大會(WCLC)上,IBI363報道了在既往接受過免疫治療的鱗狀非小細胞肺癌受試者中觀察到令人欣喜的療效信號:
在3mg/kg劑量組至少隨訪12周以上或已結束研究的患者中(n=18),ORR(客觀緩解率)為50.0%,DCR(疾病控制率)為88.9%。中位PFS(無進展生存期)未達到,仍在隨訪中。
而在1/1.5 mg/kg劑量組中,中位PFS達5.5個月,12個月PFS率為30.7%,顯示出免疫治療的長期獲益優勢;
在1/1.5/3 mg/kg劑量組中,PD-L1 TPS<1%(n=22)的受試者和TPS≥1% (n=22)的受試者ORR分別為36.4%和31.8%,提示IBI363在PD-L1低表達人群中的潛在優勢。
研究人員認為,無論PD-L1表達水平如何,IBI363均展現了強大的抗腫瘤作用,提示IBI363作用不依賴于PD-L1表達,預示IBI363不僅在免疫治療失敗人群中,在PD-L1低表達甚至不表達的冷腫瘤中,也可能帶來突破性的進展。
四川省醫藥保化品質量管理協會組織召開
2025版《中國藥典》將于2025年10月..關于舉辦四川省藥品生產企業擬新任質量
各相關企業: 新修訂的《中華人..四川省醫藥保化品質量管理協會召開第七
四川省醫藥保化品質量管理協會第七..“兩新聯萬家,黨建助振興”甘孜行活動
為深入貫徹落實省委兩新工委、省市..學習傳達中央八項規定精神專題會議
2025年4月22日,協會黨支部組織召..關于收取2025年度會費的通知
各會員單位: 在過去的一年里,..四川省應對新型冠狀病毒肺炎疫情應急指
四川省應對新型冠狀病毒肺炎疫情應..四川省應對新型冠狀病毒肺炎疫情應急指
四川省應對新型冠狀病毒肺炎疫情應..