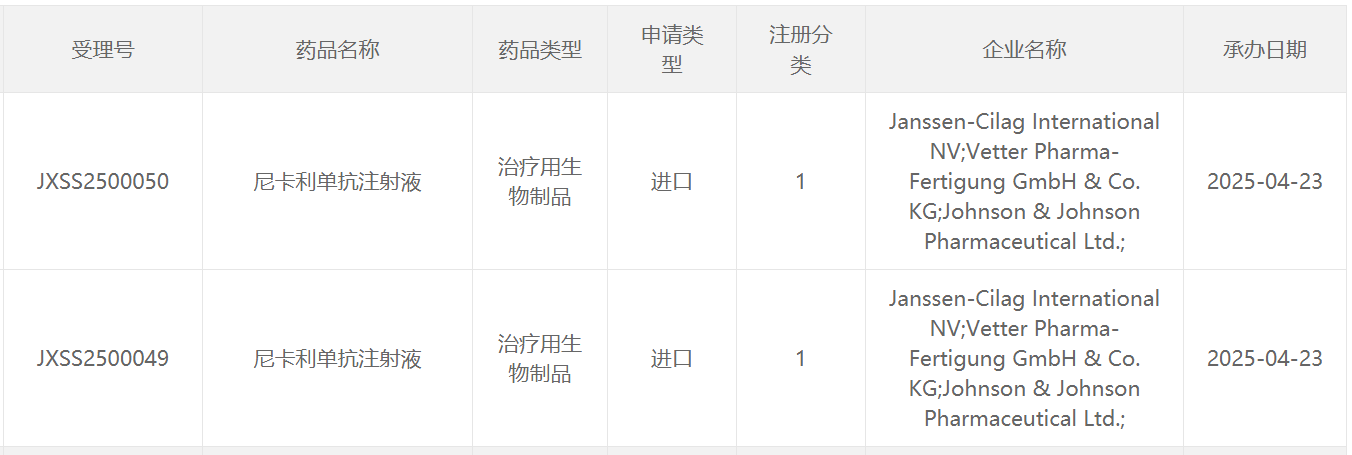
4月23日,中國國家藥監(jiān)局藥品審評中心(CDE)官網(wǎng)最新公示,強(qiáng)生公司(Johnson & Johnson)申報的1類新藥尼卡利單抗注射液的上市申請已獲得受理。公開資料顯示,尼卡利單抗(nipocalimab)是一款靶向新生兒Fc受體(FcRn)的抗體療法。該產(chǎn)品已向美國FDA申報上市,用于治療全身性重癥肌無力(gMG),PDUFA日期為4月29日。值得一提的是,這款療法還于今年年初被行業(yè)媒體Evaluate列為今年有望上市的10大潛在重磅療法之一。 在中國,該產(chǎn)品已經(jīng)于去年10月被CDE正式納入優(yōu)先審評,適用于治療自身抗體陽性(抗乙酰膽堿受體[AChR]陽性、抗肌肉特異性酪氨酸激酶[MuSK]陽性或抗低密度脂蛋白受體4 [LRP4]陽性)的全身型重癥肌無力(gMG)成人患者和青少年患者(大于12歲)。尼卡利單抗是一款靶向新生兒Fc受體的抗體療法。該產(chǎn)品通過與FcRn結(jié)合,讓被單核細(xì)胞和內(nèi)皮細(xì)胞攝入的自身抗體不會重新釋放到血液中,而是在細(xì)胞內(nèi)被降解。已有研究顯示,它可以將血液循環(huán)中包括致病自身抗體在內(nèi)的IgG水平降低超過75%。致病性IgG被認(rèn)為是自身抗體疾病的根本原因之一。此前,強(qiáng)生公司已先后向FDA和歐洲藥品管理局(EMA)提交了尼卡利單抗的上市許可申請,尋求全身型重癥肌無力(gMG)的適應(yīng)癥批準(zhǔn)。尼卡利單抗此前也已經(jīng)被CDE納入突破性治療品種,以及被FDA授予優(yōu)先審評資格,治療gMG。此外,nipocalimab還因其在治療中重度干燥綜合征的2期臨床試驗DAHLIAS的結(jié)果,被FDA授予突破性療法認(rèn)定。
2025年1月,強(qiáng)生宣布《柳葉刀》子刊The Lancet Neurology已發(fā)表其關(guān)鍵性3期臨床試驗Vivacity-MG3的結(jié)果。這項研究評估了在研療法尼卡利單抗在廣泛的抗體陽性(抗AChR、抗MuSK和抗LRP4)的全身性重癥肌無力(gMG)成年患者中的療效。研究達(dá)到主要終點,在24周內(nèi),接受尼卡利單抗治療患者的gMG疾病指標(biāo)日常生活活動評分(MG-ADL)獲得統(tǒng)計學(xué)顯著和具有臨床意義的改善。
具體而言,3期研究數(shù)據(jù)顯示,從基線開始,尼卡利單抗可使總IgG的中位水平降低最多達(dá)75%。此外,研究還觀察到常見的致病性IgG(如抗AChR抗體和抗MuSK抗體)水平在24周內(nèi)顯著下降。研究未觀察到總IgE、IgA和IgM的變化,這表明即使在致病性IgG自身抗體水平下降后,保護(hù)性免疫系統(tǒng)仍可能保持正常功能。
尼卡利單抗聯(lián)合標(biāo)準(zhǔn)治療(SOC)在MG-ADL應(yīng)答(與基線相比≥2分的改善)方面顯著優(yōu)于安慰劑聯(lián)合SOC。對于gMG患者而言,與基線相比1到2分的MG-ADL變化可能意味著從正常進(jìn)食到頻繁吞咽困難,或從靜息時呼吸短促到需要借助呼吸機(jī)的重大差異。重癥肌無力是一種自身抗體阻斷神經(jīng)突觸信號傳遞的罕見病,由針對突觸后膜上乙酰膽堿受體、肌肉特異性激酶或其他乙酰膽堿受體相關(guān)蛋白的自身抗體引起,約85%的患者會出現(xiàn)眼肌以外的癥狀,發(fā)展為全身型重癥肌無力(gMG)。對于重癥肌無力,臨床存在極大未被滿足的臨床需求。期待強(qiáng)生這款突破性抗體療法早日獲批上市,造福更多患者。