本期看點(diǎn)
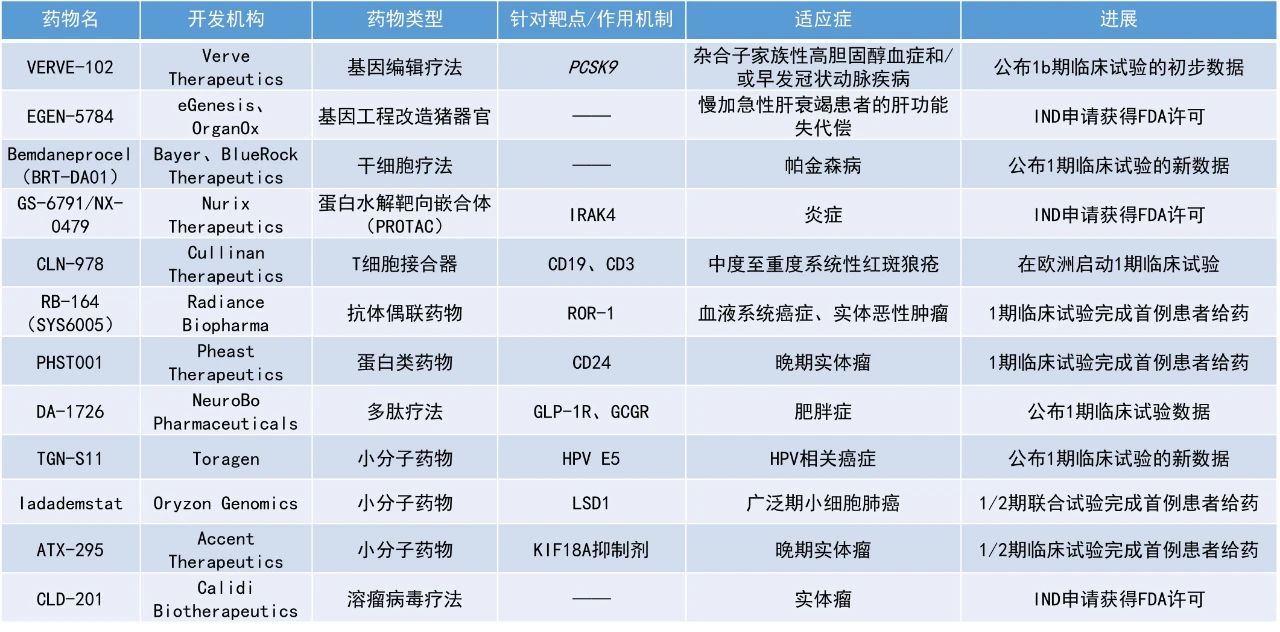
DA-1726:公布1期臨床試驗(yàn)數(shù)據(jù)
MetaVia公司宣布其在研療法DA-1726的1期臨床試驗(yàn)取得了積極結(jié)果。DA-1726是一種新型胃泌酸調(diào)節(jié)素(oxyntomodulin,OXM)類似物,具有GLP-1R和GCGR雙激動(dòng)劑的功能,可通過降低食欲和增加能量消耗來減輕體重。DA-1726被設(shè)計(jì)為每周皮下注射一次,擬開發(fā)用于治療肥胖和代謝功能障礙相關(guān)脂肪性肝炎(MASH)。
此次公布的結(jié)果顯示,在未進(jìn)行劑量滴定的情況下,接受32 mg劑量的患者在第26天時(shí)最大體重降幅達(dá)6.3%,平均降幅為4.3%(p=0.0005),空腹血糖最多降低18 mg/dL,平均降低5.3 mg/dL;第33天時(shí),腰圍最多縮小3.9英寸(約9.9厘米),平均縮小1.6英寸(約4.1厘米),顯示出胰高血糖素活性的強(qiáng)效信號(hào)。目前該公司正在追加試驗(yàn)組以確定最大耐受劑量。
EGEN-5784:IND申請(qǐng)獲得FDA許可
eGenesis和OrganOx公司宣布,美國(guó)FDA已批準(zhǔn)EGEN-5784的IND申請(qǐng)。EGEN-5784是一種適用于人體的基因工程改造豬肝臟,與OrganOx的體外肝臟交叉循環(huán)(ELC)系統(tǒng)聯(lián)用,用于治療重癥監(jiān)護(hù)環(huán)境中慢加急性肝衰竭(acute-on-chronic liver failure,ACLF)患者的肝功能失代償。
2024年11月,OrganOx與eGenesis簽署了一項(xiàng)獨(dú)家臨床共同開發(fā)協(xié)議,以推進(jìn)這一潛在的救命技術(shù),該技術(shù)面向因急性或慢加急性肝衰竭住院的患者,他們現(xiàn)有治療選擇有限,且短期死亡率高達(dá)50%。eGenesis的基因工程改造豬肝聯(lián)合OrganOx的ELC系統(tǒng),可以支持患者的肝臟功能,促使患者原生肝臟的恢復(fù),或?yàn)榛颊郀?zhēng)取足夠時(shí)間接受肝臟移植。這項(xiàng)1期試驗(yàn)將招募多達(dá)20例不適合移植的ACLF及肝性腦病(≤3級(jí))患者。
TGN-S11:公布1期臨床試驗(yàn)的新數(shù)據(jù)
Toragen公司公布了其人乳頭瘤病毒(HPV)E5癌基因蛋白小分子抑制劑TGN-S11在HPV相關(guān)癌癥患者中的1期臨床試驗(yàn)數(shù)據(jù)。研究結(jié)果顯示,TGN-S11單藥或與免疫檢查點(diǎn)抑制劑(ICI)帕博利珠單抗(pembrolizumab)聯(lián)用的安全性良好,沒有被認(rèn)為與TGN-S11相關(guān)的嚴(yán)重不良事件。此外,53%接受至少2個(gè)月治療的患者表現(xiàn)出藥物活性。基于該結(jié)果,公司將推動(dòng)其第二代E5癌基因蛋白抑制劑TGN-S15進(jìn)入臨床,該候選療法在臨床前研究中顯示出更高的療效以及更少的副作用。
ATX-295:1/2期臨床試驗(yàn)完成首例患者給藥
Accent Therapeutics公布宣布,其潛在“best-in-class”口服KIF18A抑制劑ATX-295的首次人體1/2期臨床試驗(yàn)已完成首例患者給藥。此外,ATX-295還獲得美國(guó)FDA授予的快速通道資格,用于治療晚期/轉(zhuǎn)移性鉑類耐藥或難治性卵巢癌成人患者。
ATX-295是有絲分裂驅(qū)動(dòng)蛋白KIF18A的選擇性抑制劑,該蛋白在染色體不穩(wěn)定腫瘤的細(xì)胞分裂中起關(guān)鍵作用,但在健康細(xì)胞中非必需。此前,Accent公司已證明,其新型、強(qiáng)效、選擇性小分子KIF18A抑制劑在臨床前模型(包括高級(jí)別漿液性卵巢癌和三陰性乳腺癌)中顯示出選擇性劑量依賴性腫瘤生長(zhǎng)抑制作用,支持其進(jìn)入臨床。
Iadademstat:1/2期聯(lián)合試驗(yàn)完成首例患者給藥
Oryzon Genomics公司宣布,其候選療法iadademstat聯(lián)合ICI一線治療廣泛期小細(xì)胞肺癌(SCLC)的1/2期臨床試驗(yàn)已完成首例患者給藥。Iadademstat是一種口服小分子,可作為表觀遺傳酶LSD1的高選擇性抑制劑,已在血液腫瘤中展現(xiàn)出強(qiáng)大的作用。除了血液癌,iadademstat聯(lián)合治療還在一些實(shí)體瘤中展現(xiàn)初步活性。此前,該療法已在美國(guó)獲得了用于治療SCLC的孤兒藥資格,在美國(guó)和歐盟都獲得了治療急性髓系白血病(AML)的孤兒藥資格。
GS-6791/NX-0479:IND申請(qǐng)獲得FDA許可
Nurix Therapeutics公司宣布,美國(guó)FDA已批準(zhǔn)其IRAK4降解劑GS-6791/NX-0479的IND申請(qǐng),該公司預(yù)計(jì)將于2025年第二季度啟動(dòng)1期臨床試驗(yàn)。GS-6791是一種強(qiáng)效、選擇性、口服IRAK4降解劑,靶向IRAK4蛋白激酶的支架和激酶功能,能夠阻斷toll樣受體(TLR)和促炎性IL1細(xì)胞因子受體家族(IL1Rs)下游的炎癥反應(yīng)。GS-6791降解IRAK4在治療類風(fēng)濕關(guān)節(jié)炎(RA)和其他炎癥性疾病的治療中具有潛在的應(yīng)用價(jià)值。Nurix公司的合作伙伴吉利德科學(xué)(Gilead Sciences)于2023年獲得了該項(xiàng)目的獨(dú)家授權(quán),并負(fù)責(zé)其臨床開發(fā)。
四川省醫(yī)藥保化品質(zhì)量管理協(xié)會(huì)組織召開
2025版《中國(guó)藥典》將于2025年10月..關(guān)于舉辦四川省藥品生產(chǎn)企業(yè)擬新任質(zhì)量
各相關(guān)企業(yè): 新修訂的《中華人..四川省醫(yī)藥保化品質(zhì)量管理協(xié)會(huì)召開第七
四川省醫(yī)藥保化品質(zhì)量管理協(xié)會(huì)第七..“兩新聯(lián)萬家,黨建助振興”甘孜行活動(dòng)
為深入貫徹落實(shí)省委兩新工委、省市..學(xué)習(xí)傳達(dá)中央八項(xiàng)規(guī)定精神專題會(huì)議
2025年4月22日,協(xié)會(huì)黨支部組織召..關(guān)于收取2025年度會(huì)費(fèi)的通知
各會(huì)員單位: 在過去的一年里,..四川省應(yīng)對(duì)新型冠狀病毒肺炎疫情應(yīng)急指
四川省應(yīng)對(duì)新型冠狀病毒肺炎疫情應(yīng)..四川省應(yīng)對(duì)新型冠狀病毒肺炎疫情應(yīng)急指
四川省應(yīng)對(duì)新型冠狀病毒肺炎疫情應(yīng)..