2023 年 11 月,國際人用藥品注冊協調會(ICH)正式發布Q2 (R2)和 Q14 指南,為藥品分析程序開發、驗證與注冊帶來了重大變革。3月31日,BioPhorum 團隊在深入研究后,發布了一份協會指南《分析方法開發、驗證和注冊的最佳實踐 - 生物制品領域的 ICH Q2 (R2) 和 Q14 的實施》,為行業提供了如何在實踐中遵循ICH的詳細指導。
這份指南的亮點在于提供了多個表單模板,將ICH指南中的抽象概念轉化為實踐中可以參考的工具。
分析目標概況(ATP)是ICH新指南中的關鍵概念。它明確了分析程序的目標,指導技術選擇,確保分析程序與生物制品的關鍵質量屬性(CQAs)對齊。BioPhorum強調,ATP 的定義和文檔化是分析程序開發的首要任務。通過 ATP,企業能夠科學地選擇最適合的技術平臺,為后續的驗證工作奠定基礎。
如下圖展示的是一個分析程序(ATP)的示例,該程序用于量化單克隆抗體藥物(mAb DS)中上游工藝殘留物的高效液相色譜(HPLC)程序。

曾廣泛用于工藝開發的QbD 原則也是Q14引入到分析方法開發中的。BioPhorum指出,采用系統化、基于風險的方法,能夠全面識別分析程序中的關鍵參數,并制定有效的控制策略。這種科學的開發方式,不僅提高了分析程序的穩健性和可靠性,還為后續的生命周期管理提供了有力支持。
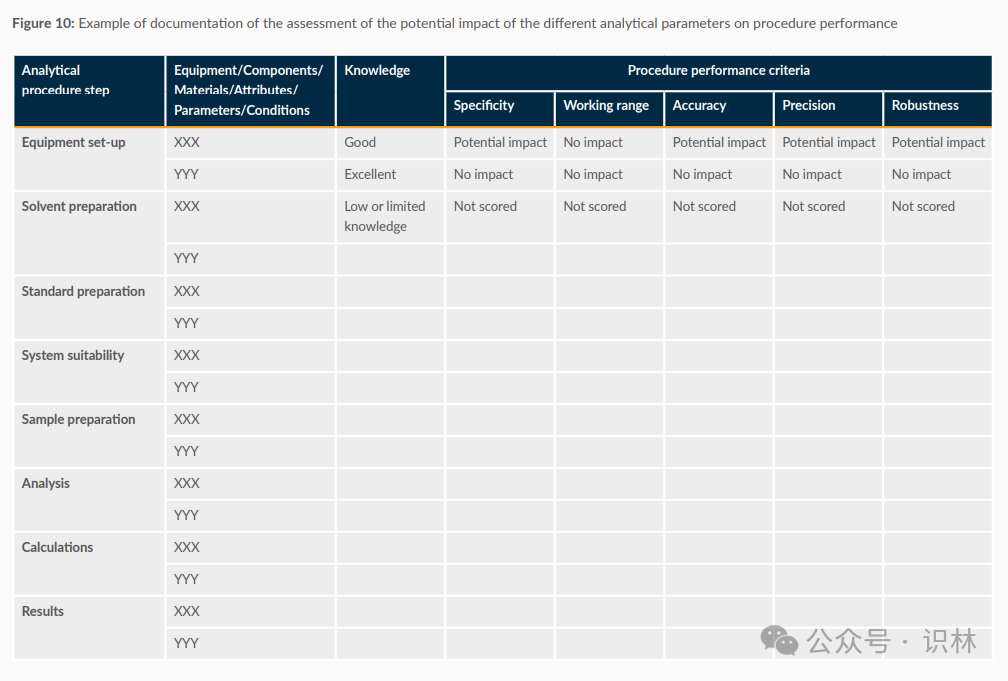
如下圖是一個關于分析程序性能評估的示例文檔,展示了不同分析參數對程序性能的潛在影響。圖中列出了分析程序的各個步驟,包括儀器設置、溶劑準備、標準準備、系統適用性、樣品準備、分析、計算和結果。每個步驟都有相應的設備/組件/材料/屬性/參數/條件和知識水平的描述。圖中還列出了程序性能標準,包括特異性、工作范圍、準確性、精確度和穩健性。每個步驟在這些性能標準下的影響被評估為“潛在影響”、“無影響”或“未評分”。
在方法學驗證環節,BioPhorum 詳細闡述了如何將開發數據有效應用于驗證過程,強調了儀器設備確認和 GMP 的重要性。同時,針對生物制品分析程序的特定性能特征,如專屬性、靈敏度等,提供了詳細的驗證指導。此外,還探討了對現有驗證研究的回顧性評估方法,以及 ICH Q2 (R2) 修訂版中新增的驗證建議。
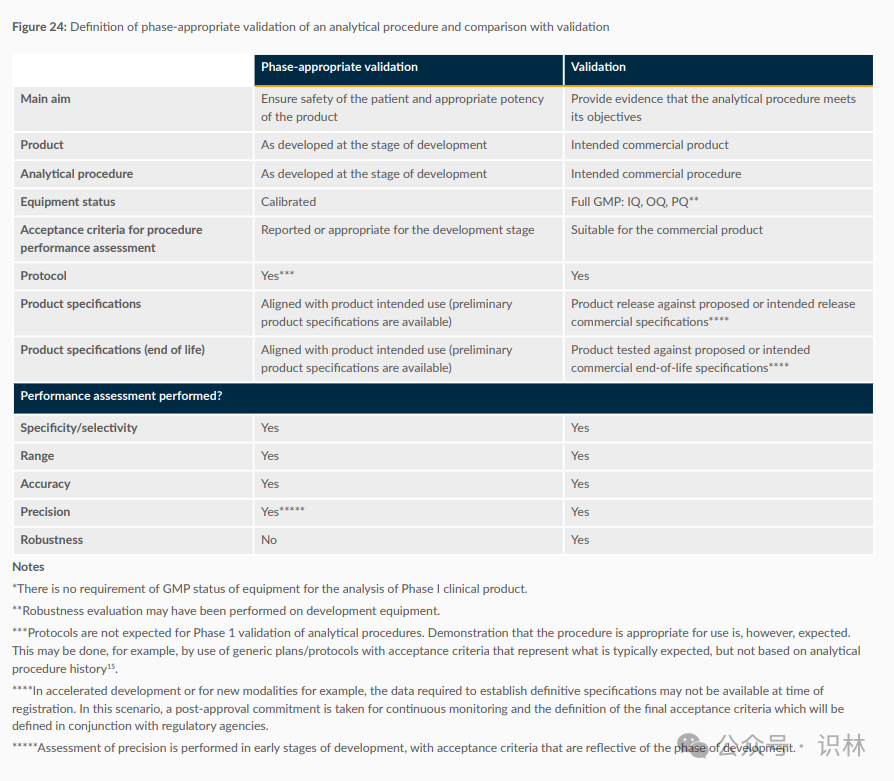
下圖展示了分析程序在不同開發階段的驗證要求,以及如何與最終的驗證進行比較。圖中分為兩部分:適應階段的驗證(Phase-appropriate validation)和最終驗證(Validation)。
在分析方法的申報和迎檢方面,BioPhorum 團隊提出企業可創建分析程序生命周期管理(APLCM)文件,以全面記錄分析程序從開發到驗證,再到變更管理的全過程。這一文件將為監管機構的評估和檢查提供清晰、完整的依據,降低監管溝通成本。
下圖展示了HPLC/紫外純度分析程序在兩個不同階段的既定條件(EC)示例,用于實踐ICH Q12的上市后變更管理理念。

四川省醫藥保化品質量管理協會組織召開
2025版《中國藥典》將于2025年10月..關于舉辦四川省藥品生產企業擬新任質量
各相關企業: 新修訂的《中華人..四川省醫藥保化品質量管理協會召開第七
四川省醫藥保化品質量管理協會第七..“兩新聯萬家,黨建助振興”甘孜行活動
為深入貫徹落實省委兩新工委、省市..學習傳達中央八項規定精神專題會議
2025年4月22日,協會黨支部組織召..關于收取2025年度會費的通知
各會員單位: 在過去的一年里,..四川省應對新型冠狀病毒肺炎疫情應急指
四川省應對新型冠狀病毒肺炎疫情應..四川省應對新型冠狀病毒肺炎疫情應急指
四川省應對新型冠狀病毒肺炎疫情應..