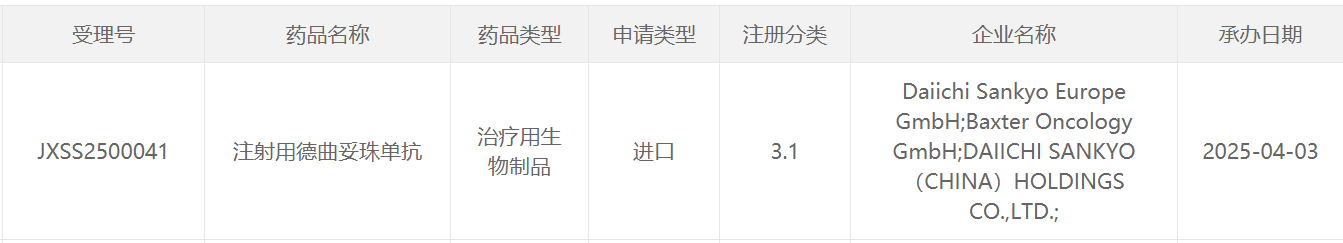
截圖來源:CDE官網
在中國,德曲妥珠單抗于2023年2月在中國首次獲NMPA批準上市,目前已獲批適應癥包括:單藥治療既往接受過抗HER2藥物治療的HER2陽性晚期乳腺癌患者;或既往在轉移性階段接受過至少一種系統治療的,或在輔助化療期間或完成輔助化療之后6個月內復發的HER2低表達(IHC 1+或IHC 2+/ISH-)晚期乳腺癌患者以及單藥治療既往接受過兩種或兩種以上治療方案的HER2陽性晚期胃或胃食管結合部腺癌患者;治療存在HER2(ERBB2)激活突變且既往接受過至少一種系統治療的不可切除的局部晚期或轉移性非小細胞肺癌(NSCLC)成人患者。
在全球范圍內,德曲妥珠單抗已獲批的適應癥涵蓋HER2陽性([IHC]3+或[ISH]+)乳腺癌;HER2低表達(IHC 1+或IHC 2+/ISH-)乳腺癌;HR陽性、HER2低表達或HER2超低表達乳腺癌;HER2(ERBB2)激活突變非小細胞肺癌;HER2陽性(IHC 3+或IHC 2+/ISH+)胃或GEJ腺癌;HER2陽性(IHC 3+)實體瘤。
根據阿斯利康官網披露的管線信息,基于DESTINY-PanTumor03研究,德曲妥珠單抗治療HER2表達實體瘤適應癥正在中國處于上市申報階段。DESTINY-PanTumor03是一項2期、多中心、開放標簽研究,旨在評估德曲妥珠單抗作為單一療法或與抗癌藥物聯合治療特定HER2表達腫瘤患者的療效和安全性。根據ClinicalTrials官網,這是一項在中國進行的2期臨床研究,在中國32個研究中心開展。
2024年4月,德曲妥珠單抗針對HER2表達實體瘤適適應證獲得FDA加速批準。這次批準主要基于在192名經治、不可切除或轉移性HER2陽性(IHC 3+)實體瘤成人患者中的療效評估結果。在DESTINY-PanTumor02中,患者的客觀緩解率(ORR)為51.4%,中位DOR為19.4個月。在DESTINY-Lung01中,ORR為52.9%,中位DOR為6.9個月。在DESTINY-CRC02中,ORR為46.9%,DOR為5.5個月。
四川省醫藥保化品質量管理協會組織召開
2025版《中國藥典》將于2025年10月..關于舉辦四川省藥品生產企業擬新任質量
各相關企業: 新修訂的《中華人..四川省醫藥保化品質量管理協會召開第七
四川省醫藥保化品質量管理協會第七..“兩新聯萬家,黨建助振興”甘孜行活動
為深入貫徹落實省委兩新工委、省市..學習傳達中央八項規定精神專題會議
2025年4月22日,協會黨支部組織召..關于收取2025年度會費的通知
各會員單位: 在過去的一年里,..四川省應對新型冠狀病毒肺炎疫情應急指
四川省應對新型冠狀病毒肺炎疫情應..四川省應對新型冠狀病毒肺炎疫情應急指
四川省應對新型冠狀病毒肺炎疫情應..