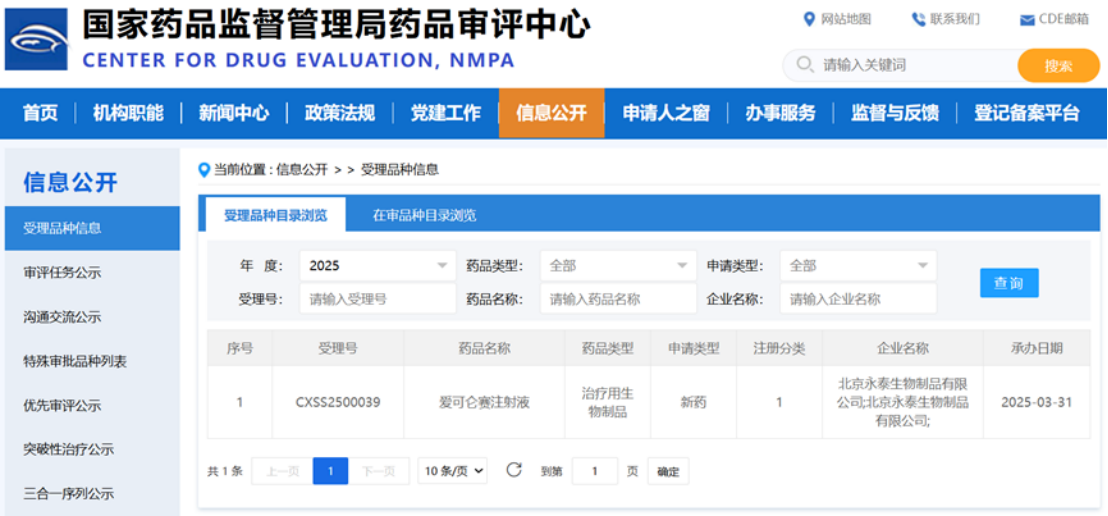
4月2日,Compass Therapeutics公布Ⅱ/Ⅲ期臨床試驗COMPANION-002的積極結果。該研究評估了在研雙特異性抗體tovecimig(原名CTX-009)聯合紫杉醇在晚期膽道癌(BTC)患者中的療效。主要終點為總緩解率(ORR)。數據顯示,在二線治療的BTC患者中,tovecimig聯合紫杉醇組的ORR為17.1%(19/111,其中1例完全緩解),而紫杉醇單藥組ORR為5.3%(3/57)。聯合治療組較單藥組ORR提高11.8%,達到統計學顯著性(p=0.031)。tovecimig可同時阻斷Delta樣配體4(DLL4)和血管內皮生長因子A(VEGF-A)信號通路,這兩種通路對血管生成和腫瘤血管化至關重要。在經過大量既往治療且對獲批抗VEGF療法耐藥的癌癥患者中,tovecimig單藥治療已觀察到部分患者獲得緩解。4月1日,AIRNA公司宣布完成1.55億美元B輪融資,將推動公司首款在研RNA編輯療法AIR-001的Ⅰ/Ⅱ期試驗,該療法旨在治療α1抗胰蛋白酶缺乏癥(AATD)。同時也將有助于加強該公司含心血管代謝疾病在內的RNA編輯療法管線。在AATD賽道,首家上市的堿基編輯公司Beam Therapeutics的一次性AATD基因療法BEAM-302最近在Ⅰ/Ⅱ期試驗中取得了早期成功,目前已在9名患者身上測試,數據顯示該療法可以降低突變蛋白水平并提高正常蛋白水平。在安全性方面,Beam公司表示未出現嚴重不良事件(SAE),僅觀察到1級(輕度)肝酶升高,且這些患者無臨床癥狀。4月1日,CDE官網顯示,海博為藥業申報的1類新藥HBW-012336 膠囊獲批臨床,用于攜帶KRAS G12D突變的局部晚期或轉移性實體瘤。這也是該藥在國內首次獲批 IND。HBW-012336是一款口服KRAS G12D抑制劑。KRAS G12D突變是KRAS突變中最常見的類型,約占整個KRAS突變的35%,且更多的出現在胰腺癌、結直腸癌等難治及治療預后差的癌癥類型。近日,CDE官網顯示,永泰生物申報的1類新藥愛可侖賽注射液附條件新藥上市申請獲得受理。這是永泰生物在研的廣譜性的細胞免疫治療產品,為針對實體瘤的CIK(細胞因子誘導殺傷細胞)療法。該產品已于今年3月正式被CDE納入優先審評,擬定適應癥為:原發性肝細胞癌根治術后高復發風險的部分人群【免疫特性人群:患者需滿足以下標準中的至少兩項:無微血管侵犯;術后中性粒細胞和淋巴細胞比值(NLR)<3;術后血小板和淋巴細胞比值(PLR)<110】術后預防復發治療。
審校:馬飛、張松
