3月19日,中國國家藥監局藥品審評中心(CDE)官網最新公示,賽諾菲(Sanofi)申報的度普利尤單抗注射液一項新適應癥上市申請擬納入優先審評,擬定適應癥為大皰性類天皰瘡。幾日前(3月11日),再生元(Regeneron)和賽諾菲公布了度普利尤單抗治療中重度大皰性類天皰瘡(BP)成人患者的關鍵性2/3期臨床研究結果,該試驗達到了所有主要及關鍵次要終點,接受度普利尤單抗治療的患者獲得持久緩解的比例是安慰劑組的5倍。目前,美國FDA已經接受度普利尤單抗用于治療成人BP的上市申請,并授予其優先審評資格。
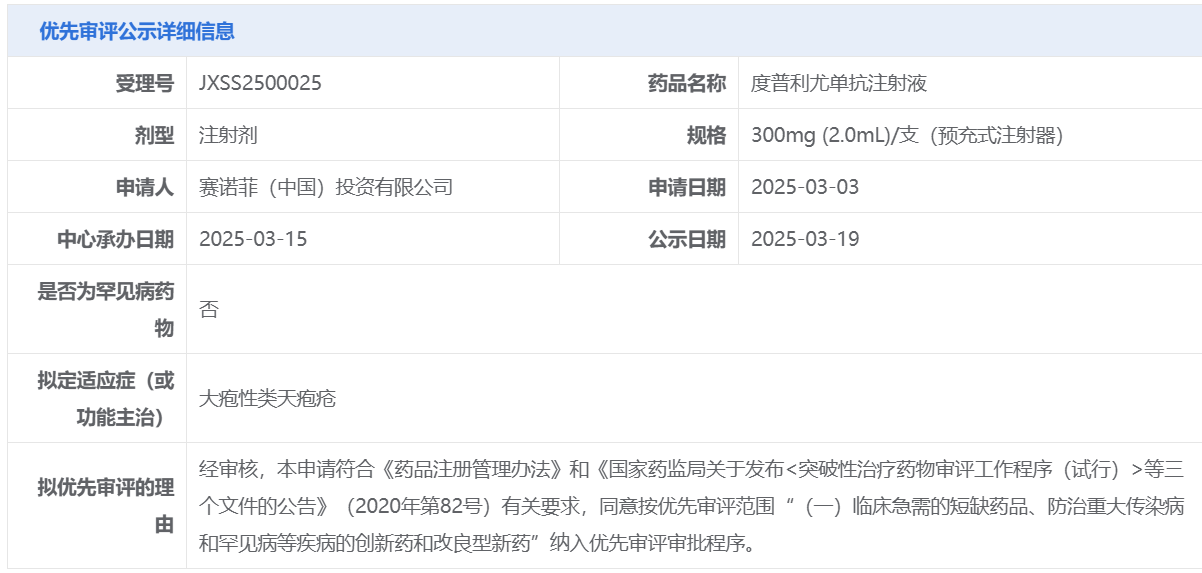
截圖來源:CDE官網
BP是一種慢性且易復發的皮膚病,伴有潛在的2型炎癥,通常發生于老年人群。其特點為劇烈瘙癢、水皰、皮膚發紅及疼痛性病變。水皰和皮疹可能遍布全身,導致皮膚出血和結痂,使患者更易感染,并影響日常生活。度普利尤單抗(dupilumab)是FDA批準的首個抗IL-4Rα抗體,由賽諾菲和再生元聯合開發。它能夠通過IL-4和IL-13“雙靶點”的創新作用機制阻斷2型炎癥通路,降低2型炎癥的病理性反應,從機制上治療2型炎癥相關疾病。研究表明,IL-4和IL-13是2型炎癥的關鍵驅動因素,在多種炎癥性疾病中發揮重要作用。今年3月,再生元和賽諾菲在2025年美國皮膚科學會(AAD)年會上公布了關鍵性2/3期臨床試驗ADEPT結果。ADEPT試驗共招募106例中重度BP成人患者,患者在接受口服皮質類固醇(OCS)治療的基礎上,被隨機分為每兩周接受度普利尤單抗(n=53)或安慰劑(n=53)治療。持續疾病緩解的定義為在16周內完成OCS遞減方案且無復發,同時在36周治療期間未使用補救治療。
在36周時,度普利尤單抗治療組患者與安慰劑組相比的結果如下:
-
20%患者實現了持續疾病緩解,而安慰劑組這一數值僅為4%;
-
40%患者的疾病嚴重程度下降≥90%,而安慰劑組為10%;
-
40%患者實現了具有臨床意義的瘙癢減輕,而安慰劑組為11%;
-
度普利尤單抗治療組平均累計OCS暴露量減少1678 mg,補救藥物使用風險降低54%。
-
在這一老年人群中,度普利尤單抗組與安慰劑組的不良事件總體發生率均為96%(n=51)。度普利尤單抗組中無因不良事件導致死亡,而安慰劑組有2例因不良事件導致死亡。
公開資料顯示,度普利尤單抗已在全球60多個國家和地區獲得一種或多種適應癥的監管批準,包括各年齡段的特應性皮炎(AD)、哮喘、慢性鼻竇炎伴鼻息肉(CRSwNP)、嗜酸性食管炎(EoE)、結節性癢疹(PN)、慢性自發性蕁麻疹(CSU)和慢性阻塞性肺疾病(COPD)。在中國,度普利尤單抗最早于2020年6月獲NMPA批準,用于治療成人中重度特應性皮炎,此后該產品陸續在中國獲批治療6歲及以上且小于12歲的兒童和成人中重度特應性皮炎、6個月至5歲嬰幼兒中重度特應性皮炎,以及治療成人結節性癢疹、12歲及以上青少年和成人哮喘患者的維持治療、血嗜酸性粒細胞升高且控制不佳的慢阻肺病成人患者。
