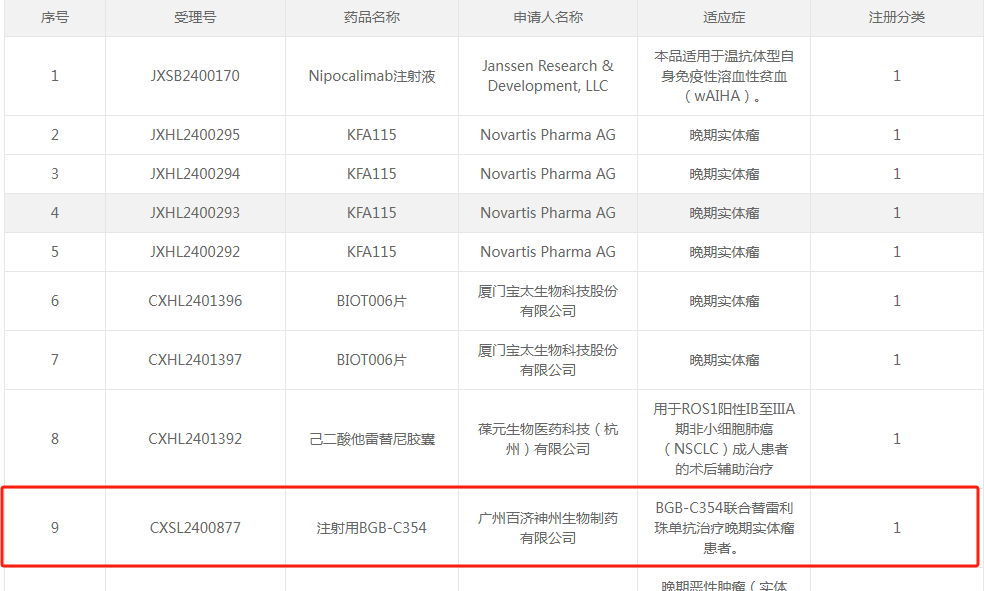
2025年3月4日,CDE官網(wǎng)顯示,百濟神州申報的1類新藥注射用BGB-C354獲得一項新的臨床試驗默示許可,擬聯(lián)合替雷利珠單抗治療晚期實體瘤患者。據(jù)悉,BGB-C354是百濟神州一款靶向B7H3(又稱CD276)的ADC產(chǎn)品,通過抗體精準識別腫瘤細胞表面的B7H3蛋白(在肺癌、乳腺癌等高發(fā)實體瘤中過度表達),定向釋放細胞毒性藥物,顯著降低對正常組織的損傷。目前該藥處于臨床I期階段,最初于2024年9月獲批IND,此次獲批適應癥為聯(lián)合替雷利珠單抗治療晚期實體瘤,預計2025年下半年將取得BGB-C354的內(nèi)部概念驗證數(shù)據(jù)。目前來看,百濟神州的ADC共有四條,均處于臨床I期階段。除靶向B7H3的ADC外,還布局三款差異化布局的ADC產(chǎn)品,分別是靶向FGFR2的BG-C137、靶向CEACAM5的BG-C477、靶向VTCN1的BG-C9074,適應癥清一色的實體瘤方向。百濟神州開發(fā)的一款FGFR2b ADC(抗體藥物偶聯(lián)物)。這種藥物主要用于治療晚期實體瘤,其作用機制是針對纖維母細胞生長因子受體2b(FGFR2b)進行靶向治療。2024年10月12日首次提交臨床申請,F(xiàn)GFR2b是胃和皮膚等上皮細胞中的FGF受體形式,約30%的HER2陰性胃食管癌患者中存在其過度表達,阻斷其激活或能減緩癌癥發(fā)展。據(jù)摩熵醫(yī)藥數(shù)據(jù)庫,2024年以來,百濟神州已有超12款1類新藥在國內(nèi)首次獲批進入臨床,涵蓋雙抗、三抗、ADC及小分子新藥等類型,其中11款為抗腫瘤新藥。2024年12月19日,BG-C137獲批臨床。作為一款靶向癌胚抗原(CEA)的ADC候選藥物,CEA是一種糖蛋白,在多種類型的癌細胞中廣泛表達,并在細胞遷移、侵襲和黏附中起關鍵作用。CEA幾乎不在其他正常細胞中表達,是實體腫瘤治療的理想靶點。作為CEA調(diào)節(jié)劑,該藥物設計原理基于一旦與癌細胞表面的CEA結合,整個ADC復合物就會被細胞內(nèi)化,隨后釋放細胞毒性藥物殺死癌細胞。資料介紹,百濟神州的該款ADC的設計,采用新型拓撲異構酶抑制劑作為Payload,DAR值可達8,臨床前研究中表現(xiàn)出優(yōu)于SAR701的抗腫瘤活性。該產(chǎn)品具有差異化ADC設計以提升CEA陽性肺癌和胃腸道癌患者療效,也可在中低表達患者中實現(xiàn)廣泛靶向。該款ADC是一款靶向B7H4的抗體偶聯(lián)藥物(ADC)。是百濟神州于2023年7月從映恩生物引進的一款ADC產(chǎn)品(全球開發(fā)和商業(yè)化權利)。B7H4作為最新發(fā)現(xiàn)的B7家族成員之一,為一種在多種腫瘤中過度表達的細胞表面蛋白,可幫助腫瘤細胞逃避免疫系統(tǒng)的監(jiān)測。研究表明,B7H4在三陰性乳腺癌(74%)、卵巢癌(77%)、子宮內(nèi)膜癌(94%)和膽管癌(89%)中最常見,而在正常組織中的表達有限。此外,B7H4獨立于PD-L1表達,通常在PD-L1陰性腫瘤中高表達,展示出區(qū)別于PD-1/L1的另一種免疫逃逸機制。這表明針對B7H4通路的療法有望對PD-L1陰性/難治性患者發(fā)揮作用。2024年7月30日,百濟神州在藥物臨床試驗登記與信息公示平臺網(wǎng)站上注冊了BG-C9074單藥治療及其與替雷利珠單抗聯(lián)合用藥治療晚期實體瘤患者的1a/1b期首次人體研究。很明顯,相比絕大多數(shù)Biotech企業(yè)就ADC的同質(zhì)化布局,百濟神州毅然選擇B7H3等競爭較少的靶點,并聚焦實體瘤領域,并試圖與自身PD-1等管線形成聯(lián)用潛力。這種“靶點差異化+技術改良+全球協(xié)同”的布局也正是其核心競爭所在,但無論如何,企業(yè)的長期成功依賴數(shù)據(jù)較多,對于百濟神州在ADC能否取得成功,或許還要考慮后期臨床數(shù)據(jù)的驗證、商業(yè)化效率的提升以及對新興技術趨勢的快速響應能力。