華東醫藥GLP-1類雙靶點新藥再獲批兩項臨床
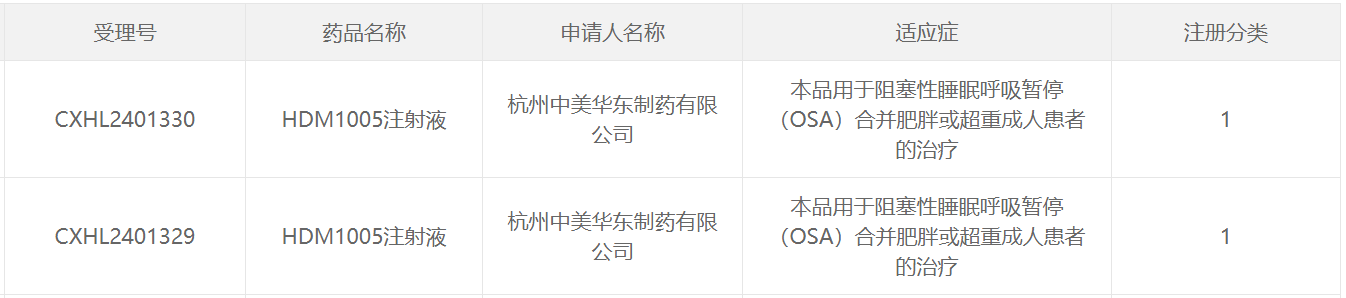
今日,中國國家藥監局藥品審評中心(CDE)官網最新公示,華東醫藥1類新藥HDM1005注射液獲得兩項新的臨床試驗默示許可,擬開發用于阻塞性睡眠呼吸暫停(OSA)合并肥胖或超重成人患者的治療。公開資料顯示,HDM1005是華東醫藥在研的一款多肽類GLP-1受體和GIP受體的雙靶點激動劑,此前已經在中國和美國獲得過多項IND。
OSA是因為在睡眠過程中氣道阻塞,導致頻繁出現呼吸暫停的常見疾病,通常伴隨著夜間響亮的鼾聲。因為呼吸暫停導致大腦缺氧,喚醒患者打開氣道,OSA患者往往不能正常睡眠,同時可能引發嚴重的心臟代謝并發癥,如高血壓、冠狀動脈疾病、中風、心力衰竭、心房顫動及2型糖尿病。在過去多年,這種疾病的治療幾乎未見明顯進展,許多患者需要在睡眠中使用正壓通氣(PAP)裝置來維持通氣,但此類治療效果有限,且許多患者難以適應佩戴帶來的不適。近年來,GLP-1類藥物為這類患者的治療帶來新的希望。
相關文獻和研究表明,脂肪在上呼吸道的沉積、肌肉結構的改變以及胸腹壁脂肪的堆積均可能導致OSA。鑒于肥胖與OSA間的關系,臨床診療指南建議對OSA患者的肥胖進行治療。
HDM1005注射液是中美華東研發的1類化學新藥,是多肽類人GLP-1受體和GIP受體的雙靶點長效激動劑。根據華東醫藥此前公開資料介紹,臨床前研究和已有的臨床1期數據顯示,HDM1005具有顯著的減重效果;具有改善OSA合并肥胖或超重患者相關癥狀的潛力。
在中國,HDM1005已經獲批多項IND,擬開發適應癥包括2型糖尿病和超重或肥胖人群體重管理、代謝相關脂肪性肝病/代謝相關脂肪性肝炎。在美國,該產品用于體重管理、代謝相關脂肪性肝炎、“用于OSA合并肥胖或超重患者的治療”、“用于HFpEF合并肥胖患者的治療”四個適應癥的IND申請均已獲得FDA批準。
信達生物雙抗1類新藥獲批臨床,針對哮喘
今日,中國國家藥監局藥品審評中心(CDE)官網最新公示,信達生物申報的1類新藥IBI3002獲批臨床,擬開發治療哮喘。根據信達生物公開資料,IBI3002是其自主研發的一款抗IL-4Rα/TSLP雙特異性抗體,目前正在澳大利亞開展1期臨床研究。本次是該產品首次在中國獲批IND。

哮喘是一種由多種免疫細胞、細胞因子及炎癥介質介導,累及全年齡段人群的異質性疾病,以喘息、氣促、咳嗽和胸悶等多種癥狀為特征,與慢性氣道炎癥、可變的氣流受限和氣道高反應性相關。相關數據顯示,高達10%的成人哮喘患者和2.5%的兒童哮喘患者患有重度哮喘。盡管接受了足夠的大劑量吸入治療,重度哮喘患者仍存在癥狀持續或頻繁急性加重,需要反復系統性糖皮質激素短期或維持治療。在這些患者中,需要給予額外治療(可能包括生物制劑)以減輕疾病負擔。
IBI3002是一種靶向白細胞介素4受體α(IL-4Rα)和胸腺基質淋巴細胞生成素(TSLP)的雙特異性抗體,其靶向細胞表面IL-4Rα和警報素細胞因子TSLP,擬開發用于治療包括哮喘在內的炎癥性疾病。IL-4受體介導了IL-4信號通路(1型和2型)和IL-13信號通路(2型),兩種細胞因子信號通路在2型炎癥性疾病的病理生理學中均起關鍵作用。TSLP是一種上皮細胞來源的警報素細胞因子,可觸發哮喘中的2型和非2型炎癥。
四川省醫藥保化品質量管理協會組織召開
2025版《中國藥典》將于2025年10月..關于舉辦四川省藥品生產企業擬新任質量
各相關企業: 新修訂的《中華人..四川省醫藥保化品質量管理協會召開第七
四川省醫藥保化品質量管理協會第七..“兩新聯萬家,黨建助振興”甘孜行活動
為深入貫徹落實省委兩新工委、省市..學習傳達中央八項規定精神專題會議
2025年4月22日,協會黨支部組織召..關于收取2025年度會費的通知
各會員單位: 在過去的一年里,..四川省應對新型冠狀病毒肺炎疫情應急指
四川省應對新型冠狀病毒肺炎疫情應..四川省應對新型冠狀病毒肺炎疫情應急指
四川省應對新型冠狀病毒肺炎疫情應..