本期看點(diǎn)
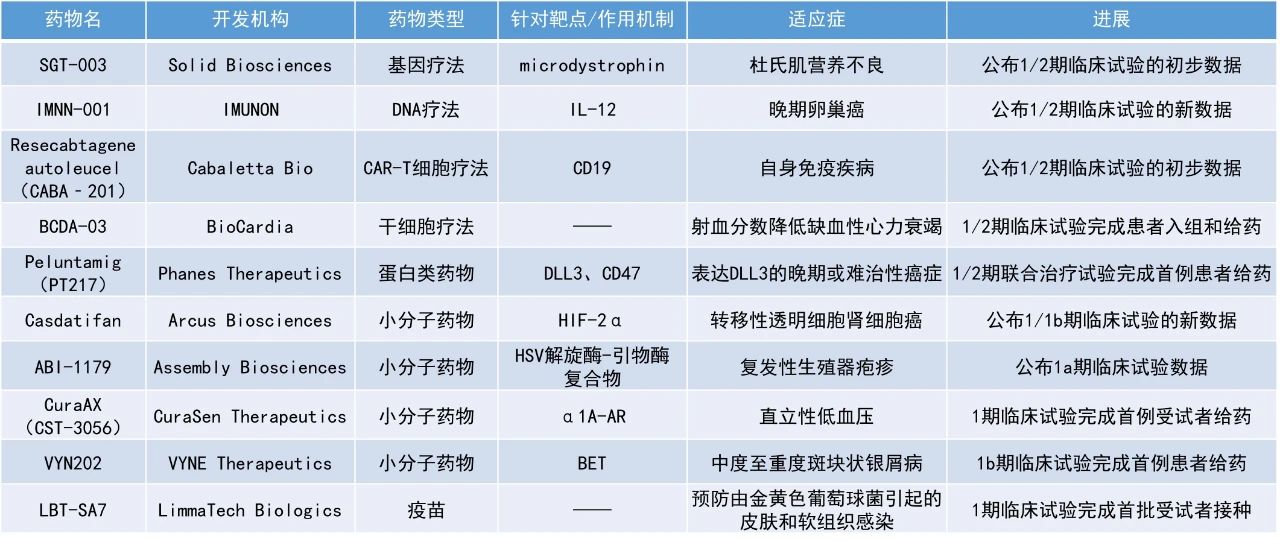
Casdatifan:公布1/1b期臨床試驗(yàn)的新數(shù)據(jù)
Arcus Biosciences公司公布了其候選療法casdatifan的臨床1/1b期試驗(yàn)ARC-20的最新數(shù)據(jù)。Casdatifan是一款在研HIF-2α小分子抑制劑。HIF-2α是一種參與多器官和腫瘤氧感應(yīng)的促腫瘤轉(zhuǎn)錄因子。透明細(xì)胞腎細(xì)胞癌幾乎普遍存在HIF-2α調(diào)控異常。這會(huì)導(dǎo)致假性缺氧狀態(tài),并異常增加HIF-2α介導(dǎo)的廣泛促癌蛋白表達(dá)。Casdatifan通過(guò)選擇性抑制HIF-2α,旨在阻斷多種與腫瘤增殖、生存、耐藥和血管生成相關(guān)的通路,從而導(dǎo)致癌細(xì)胞死亡。
此次公布的數(shù)據(jù)顯示,在接受每日兩次casdatifan(50 mg)治療的轉(zhuǎn)移性透明細(xì)胞腎細(xì)胞癌患者隊(duì)列中,無(wú)進(jìn)展生存期(PFS)達(dá)到9.7個(gè)月,其它劑量組的PFS尚未達(dá)到。在所有3個(gè)劑量組中,casdatifan的疾病控制率均超過(guò)80%。安全性方面,casdatifan在所有劑量下均具有可接受且可控的安全性。新聞稿表示,與迄今為止發(fā)表的HIF-2α抑制劑研究數(shù)據(jù)相比,casdatifan在總緩解率(ORR)和中位PFS方面均顯示出改善,這些數(shù)據(jù)展現(xiàn)了casdatifan成為“best-in-class”療法的潛力。
Resecabtagene autoleucel(CABA‐201):公布1/2期臨床試驗(yàn)的初步數(shù)據(jù)
Cabaletta Bio公司公布了RESET臨床開(kāi)發(fā)項(xiàng)目中首批10例接受CAR-T細(xì)胞療法resecabtagene autoleucel(rese‐cel,前稱CABA‐201)治療的自身免疫疾病患者的最新數(shù)據(jù)。Rese‐cel是一款靶向CD19的在研CAR-T細(xì)胞療法,針對(duì)在自身免疫疾病中起到重要作用的B細(xì)胞。通過(guò)一次輸注,rese‐cel旨在短暫且深度清除外周循環(huán)及組織內(nèi)所有CD19陽(yáng)性細(xì)胞。這一方法有望重置免疫系統(tǒng),并在患者中實(shí)現(xiàn)深遠(yuǎn)的臨床緩解,而無(wú)需長(zhǎng)期持續(xù)治療。
RESET臨床開(kāi)發(fā)項(xiàng)目涵蓋6項(xiàng)1/2期臨床試驗(yàn),涉及風(fēng)濕病學(xué)、神經(jīng)病學(xué)及皮膚病學(xué)等治療領(lǐng)域。截至2025年1月8日的數(shù)據(jù),多位患者在停止使用免疫抑制藥物的情況下,獲得或加深癥狀緩解。Rese‐cel在輸注后第一個(gè)月內(nèi)持續(xù)表現(xiàn)出對(duì)外周B細(xì)胞的深度清除。安全性方面,在首批接受rese‐cel治療且至少隨訪1個(gè)月的10例患者中,90%的患者未出現(xiàn)細(xì)胞因子釋放綜合征(CRS)或僅出現(xiàn)1級(jí)CRS,且90%的患者未出現(xiàn)免疫效應(yīng)細(xì)胞相關(guān)神經(jīng)毒性綜合征。
SGT-003:公布1/2期臨床試驗(yàn)的初步數(shù)據(jù)
Solid Biosciences公司公布了其新一代基因療法SGT-003在1/2期臨床試驗(yàn)INSPIRE DUCHENNE中的初步數(shù)據(jù)。SGT-003是一種旨在治療杜氏肌營(yíng)養(yǎng)不良的潛在“best-in-class”的基因療法,采用獨(dú)特的微抗肌萎縮蛋白結(jié)構(gòu)和專有的新一代衣殼載體AAV-SLB101。該載體經(jīng)過(guò)精心設(shè)計(jì),可靶向整合素受體,在非臨床研究中顯示出增強(qiáng)的心臟和骨骼肌轉(zhuǎn)導(dǎo)效果,同時(shí)降低了對(duì)肝臟的靶向性。
此次公布的結(jié)果顯示,前三名受試者的90天活檢數(shù)據(jù)顯示,患者平均微抗肌萎縮蛋白表達(dá)量達(dá)到110%,且多個(gè)反映肌肉健康的生物標(biāo)志物均有所改善。此外,還觀察到患者可能獲得心臟益處的早期積極信號(hào):在第180天,依據(jù)左心室射血分?jǐn)?shù)測(cè)量,兩名參與者的平均心臟功能較基線提高了8%;而在第90天,一名入組時(shí)血清心臟高敏肌鈣蛋白I(hs-cTnI)水平升高的患者,其hs-cTnI水平降低了36%。
截至2025年2月11日,已有6名參與者接受了SGT-003治療,均耐受良好,未出現(xiàn)嚴(yán)重不良事件。該試驗(yàn)仍在招募患者中,預(yù)計(jì)到2025年第四季度將有約20名受試者接受治療。該公司計(jì)劃于2025年中期與FDA會(huì)面,討論SGT-003的潛在加速批準(zhǔn)途徑。
IMNN-001:公布1/2期臨床試驗(yàn)的新數(shù)據(jù)
IMUNON公司公布了其在研免疫療法IMNN-001在治療晚期卵巢癌患者的1/2期臨床試驗(yàn)OVATION 2中取得的新數(shù)據(jù)。IMNN-001是IMUNON公司開(kāi)發(fā)的一種基于DNA的IL-12免疫療法,用于晚期卵巢癌的局部治療。IMNN-001采用IMUNON專有的TheraPlas平臺(tái)技術(shù)設(shè)計(jì),是一種包裹在納米顆粒遞送系統(tǒng)中表達(dá)IL-12的DNA質(zhì)粒載體,可實(shí)現(xiàn)細(xì)胞轉(zhuǎn)染,然后使局部組織持續(xù)分泌IL-12蛋白。
OVATION 2旨在評(píng)估IMNN-001與新輔助和輔助化療(NACT)聯(lián)合使用,與僅使用標(biāo)準(zhǔn)療法NACT相比,在新確診的晚期上皮性卵巢癌、輸卵管癌或原發(fā)性腹膜癌患者中的療效與安全性。此次公布的結(jié)果顯示,接受100 mg/m²劑量與79 mg/m²劑量相比,患者的IL-12水平提高了20%。IMNN-001繼續(xù)顯示出良好的安全性,沒(méi)有報(bào)告嚴(yán)重的免疫相關(guān)不良事件。2024年12月,該公司報(bào)告使用100 mg/m²劑量的IMNN-001加上標(biāo)準(zhǔn)治療NACT的患者的中位總生存期(OS)比單獨(dú)使用標(biāo)準(zhǔn)治療的患者延長(zhǎng)了13個(gè)月。試驗(yàn)中有超過(guò)三分之一的患者從入組時(shí)開(kāi)始計(jì)算,已存活超過(guò)36個(gè)月,其中62%來(lái)自IMNN-001治療組,38%來(lái)自標(biāo)準(zhǔn)護(hù)理組。超過(guò)10%的受試者達(dá)到了48個(gè)月或更長(zhǎng)的生存期。
ABI-1179:公布1a期臨床試驗(yàn)數(shù)據(jù)
Assembly Biosciences公司公布了其在研長(zhǎng)效單純皰疹病毒(HSV)解旋酶-引物酶抑制劑ABI-1179在1a期臨床試驗(yàn)中取得的積極中期結(jié)果。該候選療法通過(guò)靶向病毒解旋酶-引物酶復(fù)合體發(fā)揮作用。這是一種在HSV-1和HSV-2中都保守的重要病毒酶復(fù)合體,并且宿主細(xì)胞中沒(méi)有類似的酶復(fù)合體。在短期臨床研究中,HSV解旋酶-引物酶抑制劑顯示出比核苷類似物更佳的療效潛力。
此次公布的結(jié)果顯示,ABI-1179的半衰期約為4天,在評(píng)估的劑量范圍內(nèi)表現(xiàn)出高暴露量,支持每周一次低劑量口服給藥的目標(biāo)方案。該藥物耐受性良好,顯示出有利的安全性特征,并在所有評(píng)估劑量(包括最低劑量50 mg)中,均達(dá)到了抗病毒活性所需的目標(biāo)血漿濃度。基于這些結(jié)果,該公司計(jì)劃直接進(jìn)入ABI-1179的1b期研究,該研究將在患有復(fù)發(fā)性生殖器皰疹的患者中進(jìn)行。
LBT-SA7:1期臨床試驗(yàn)完成首批受試者接種
LimmaTech Biologics公司宣布,其候選多價(jià)疫苗LBT-SA7的1期對(duì)照研究已完成首批受試者接種。該公司還宣布從抗擊抗生素耐藥細(xì)菌生物制藥加速器(CARB-X)獲得了650萬(wàn)美元的資助,以推進(jìn)LBT-SA7的臨床開(kāi)發(fā)。
LBT-SA7旨在預(yù)防由金黃色葡萄球菌引起的皮膚和軟組織感染,這種感染每年在全球范圍內(nèi)導(dǎo)致約100萬(wàn)人死亡。目前,由于缺乏有效的疫苗,以及針對(duì)耐藥菌株的治療選擇有限,急需新的預(yù)防措施。新聞稿指出,LBT-SA7是首個(gè)基于分泌抗原的多價(jià)疫苗,含有病原體毒素的弱化形式(類毒素),旨在誘導(dǎo)機(jī)體產(chǎn)生中和抗體中和金黃色葡萄球菌分泌的毒素來(lái)預(yù)防感染,有望成為一種有效的預(yù)防措施。
四川省醫(yī)藥保化品質(zhì)量管理協(xié)會(huì)組織召開(kāi)
2025版《中國(guó)藥典》將于2025年10月..關(guān)于舉辦四川省藥品生產(chǎn)企業(yè)擬新任質(zhì)量
各相關(guān)企業(yè): 新修訂的《中華人..四川省醫(yī)藥保化品質(zhì)量管理協(xié)會(huì)召開(kāi)第七
四川省醫(yī)藥保化品質(zhì)量管理協(xié)會(huì)第七..“兩新聯(lián)萬(wàn)家,黨建助振興”甘孜行活動(dòng)
為深入貫徹落實(shí)省委兩新工委、省市..學(xué)習(xí)傳達(dá)中央八項(xiàng)規(guī)定精神專題會(huì)議
2025年4月22日,協(xié)會(huì)黨支部組織召..關(guān)于收取2025年度會(huì)費(fèi)的通知
各會(huì)員單位: 在過(guò)去的一年里,..四川省應(yīng)對(duì)新型冠狀病毒肺炎疫情應(yīng)急指
四川省應(yīng)對(duì)新型冠狀病毒肺炎疫情應(yīng)..四川省應(yīng)對(duì)新型冠狀病毒肺炎疫情應(yīng)急指
四川省應(yīng)對(duì)新型冠狀病毒肺炎疫情應(yīng)..