本期看點
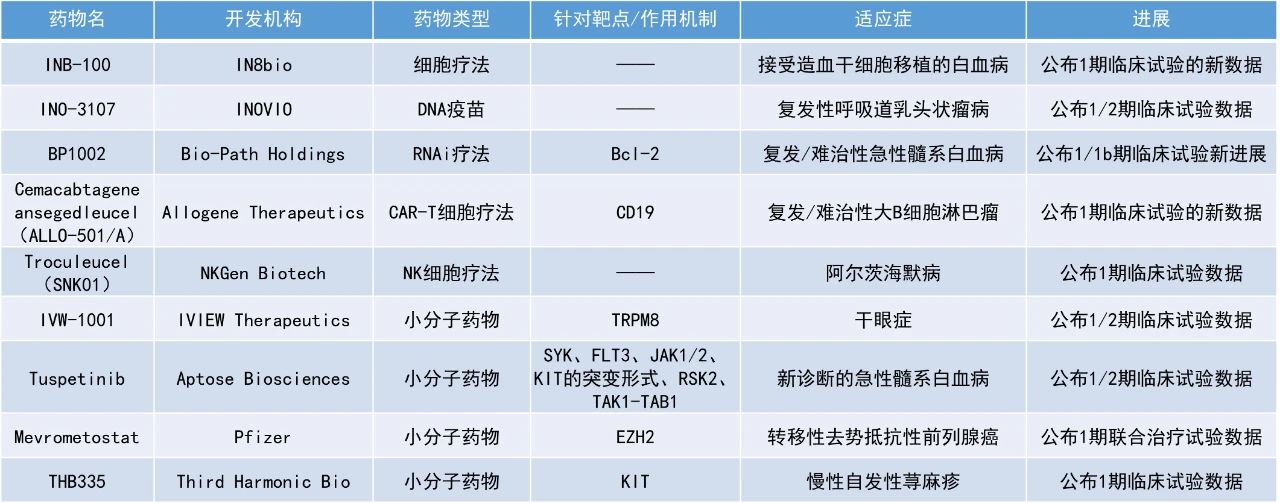
INB-100:公布1期臨床試驗的新數(shù)據(jù)
IN8bio公司公布了其在研現(xiàn)貨型γδ T細(xì)胞療法INB-100用于造血干細(xì)胞移植后的白血病患者的1期臨床試驗數(shù)據(jù)。INB-100是一款來自健康供體的同種異體γδ T細(xì)胞,在體外經(jīng)過擴(kuò)增和激活后,被輸注到白血病患者體內(nèi)。
截至2025年1月17日的數(shù)據(jù),中位隨訪時間為20.1個月,接受INB-100治療的原始隊列和擴(kuò)展隊列中,所有(100%)AML患者仍保持CR狀態(tài),其中有幾名患者的緩解時間已超過3年。此外,與真實世界的歷史數(shù)據(jù)相比,接受INB-100治療的患者相比于接受標(biāo)準(zhǔn)治療的患者展現(xiàn)出顯著更高的一年無進(jìn)展生存率和總生存率。即使是接受低強(qiáng)度預(yù)處理(RIC)的老年高危患者,INB-100也顯示出顯著的療效。安全性方面,未報告細(xì)胞因子釋放綜合征(CRS)或神經(jīng)毒性,移植物抗宿主病(GvHD)可控,感染輕微,對患者的生活質(zhì)量無明顯影響。
Cemacabtagene ansegedleucel(ALLO-501/A):公布1期臨床試驗的新數(shù)據(jù)
Allogene Therapeutics公司宣布,其在研同種異體CAR-T療法cemacabtagene ansegedleucel(cema-cel,以前稱為ALLO-501/A)用于治療R/R LBCL的1期臨床試驗數(shù)據(jù)已發(fā)表在Journal of Clinical Oncology期刊上。Cema-cel是一種經(jīng)基因工程改造、靶向CD19的AlloCAR-T產(chǎn)品。Cema-cel通過TALEN基因編輯技術(shù)破壞TRAC與CD52基因,以減少產(chǎn)生GvHD的風(fēng)險。此前,美國FDA授予cema-cel再生醫(yī)學(xué)先進(jìn)療法(RMAT)認(rèn)定,用于治療R/R LBCL。
數(shù)據(jù)顯示,cema-cel的療效與已批準(zhǔn)的自體CD19靶向CAR-T細(xì)胞療法相當(dāng):該研究中的總緩解率(ORR)和CR率分別為58%和42%,其中所選定用于關(guān)鍵2期試驗的方案獲得了最高的ORR和CR,分別為67%和58%。在達(dá)到CR的患者中,中位緩解持續(xù)時間(DOR)為23.1個月,中位總生存期(OS)尚未達(dá)到。此外,cema-cel的安全性可控,且與已批準(zhǔn)的自體CD19靶向CAR-T細(xì)胞療法一致。值得注意的是,cema-cel治療在低疾病負(fù)荷患者中的CR率達(dá)100%。該結(jié)果為cema-cel作為LBCL患者的一線鞏固治療提供了支持,相關(guān)關(guān)鍵性2期試驗ALPHA3已于2024年6月啟動。
Troculeucel(SNK01):公布1期臨床試驗數(shù)據(jù)
NKGen Biotech公司公布了其自體增強(qiáng)型自然殺傷(NK)細(xì)胞療法troculeucel(SNK01)用于治療阿爾茨海默病的1期臨床試驗數(shù)據(jù)。Troculeucel是一款自體、非基因工程改造的NK細(xì)胞產(chǎn)品,它具有增強(qiáng)的細(xì)胞毒性,活化受體表達(dá)率超過90%,可從任何供體中穩(wěn)定生產(chǎn)。該候選療法能夠有效降低AD患者腦脊液(CSF)中的α-突觸核蛋白(α-syn)水平,該蛋白的升高被認(rèn)為與認(rèn)知能力下降有關(guān)。
此次公布的結(jié)果顯示,10名可評估患者中,90%患者的認(rèn)知功能穩(wěn)定或有所改善。此外,troculeucel療法耐受性良好,并對腦脊液中的蛋白質(zhì)聚集體水平和神經(jīng)炎癥生物標(biāo)志物產(chǎn)生了有益影響,其中pTau181和膠質(zhì)纖維酸性蛋白(GFAP)的減少似乎與劑量相關(guān)。
INO-3107:公布1/2期臨床試驗數(shù)據(jù)
INOVIO公司宣布,其候選DNA療法INO-3107的1/2期臨床試驗數(shù)據(jù)已發(fā)表于學(xué)術(shù)期刊Nature Communications。INO-3107正在被開發(fā)用于治療成人HPV 6和HPV 11相關(guān)的復(fù)發(fā)性呼吸道乳頭狀瘤病(RRP),旨在引發(fā)針對HPV 6和HPV 11的靶向T細(xì)胞反應(yīng),以殺死受感染的細(xì)胞,使乳頭狀瘤消退。該療法還可能清除或降低病毒水平,從而防止或減緩新乳頭狀瘤的生長。
數(shù)據(jù)顯示,與前一年相比,使用INO-3107治療的32名受試者中,有26名(81.3%)手術(shù)干預(yù)次數(shù)降低,其中9名(28.1%)受試者在試驗期間無需手術(shù)干預(yù),ORR為72%。此外,INO-3107具有良好的耐受性和免疫原性,未報告>2級的治療相關(guān)不良事件。2020年,F(xiàn)DA授予INO-3107孤兒藥資格,用于治療RRP。該公司計劃在2025年年中提交INO-3107的生物制品許可申請(BLA)。
Mevrometostat:公布1期聯(lián)合治療試驗數(shù)據(jù)
輝瑞(Pfizer)公布了其開發(fā)的EZH2抑制劑mevrometostat與雄激素受體抑制劑Xtandi(enzalutamide)聯(lián)用,治療轉(zhuǎn)移性去勢抵抗性前列腺癌(mCRPC)患者的1期臨床試驗的首個隨機(jī)無進(jìn)展生存期(PFS)結(jié)果。Mevrometostat是一款選擇性、口服強(qiáng)效EZH2抑制劑。EZH2是基因轉(zhuǎn)錄的重要調(diào)控因子,在前列腺癌中與癌細(xì)胞增殖相關(guān)。在臨床前模型中,mevrometostat與enzalutamide表現(xiàn)出協(xié)同作用,能夠進(jìn)一步抑制前列腺癌細(xì)胞系的增殖。
截至2024年9月2日的數(shù)據(jù),中位隨訪時間為9.6個月,mevrometostat加enzalutamide組患者的中位放射學(xué)PFS為14.3個月(7.5個月,不可評估),enzalutamide組患者在此數(shù)值上為6.2個月(4.1個月,13.9個月)。Mevrometostat/enzalutamide組合與enzalutamide相比,將疾病進(jìn)展或死亡風(fēng)險降低49%(HR=0.51,90% CI:0.28,0.95)。此外,在基線時攜帶可評估病灶的患者中,mevrometostat/enzalutamide組合組的總緩解率為26.7%,enzalutamide單藥組這一數(shù)值為15.4%。
Tuspetinib:公布1/2期臨床試驗數(shù)據(jù)
Aptose Biosciences公司公布了1/2期TUSCANY試驗的初步結(jié)果,該試驗評估了FLT3抑制劑tuspentinib與venetoclax和azacitidine聯(lián)用治療新確診的AML患者的效果。結(jié)果顯示,3例FLT3野生型患者完成了第1個周期的治療,無劑量限制性毒性(DLT)且無劑量調(diào)整。有兩名患者在第1個治療周期結(jié)束時達(dá)到CR加部分血液學(xué)恢復(fù)的完全緩解(CRh)。值得注意的是,其中有1例是具有雙等位基因TP53突變和復(fù)雜核型的患者。第3名患者在第1個治療周期內(nèi)骨髓白血病細(xì)胞顯著減少,并繼續(xù)接受第2個周期的治療。
IVW-1001:公布1/2期臨床試驗數(shù)據(jù)
IVIEW Therapeutics公司公布了其創(chuàng)新療法IVW-1001用于治療干眼癥的1/2期臨床試驗數(shù)據(jù)。IVW-1001是一款含有TRPM8激動劑的眼部濕巾。此次公布的結(jié)果顯示,IVW-1001在第4周時對干眼癥患者的體征和癥狀產(chǎn)生了具有統(tǒng)計學(xué)和臨床意義的改善,包括角膜熒光素染色的減少和眼干評分的顯著降低。此外,淚液分泌量也有積極變化。研究還顯示出劑量與效果間的關(guān)系,較高劑量(0.2%)在多個療效終點上表現(xiàn)更優(yōu)。安全性方面,IVW-1001在所有治療組中均表現(xiàn)出良好的耐受性,大多數(shù)不良事件為輕度或中度。
THB335:公布1期臨床試驗數(shù)據(jù)
Third Harmonic Bio公司公布了其強(qiáng)效、選擇性口服小分子KIT抑制劑THB335在健康受試者中的1期臨床試驗結(jié)果。結(jié)果顯示,THB335具有約40小時的半衰期,支持每日一次給藥,并在多個劑量水平下顯示出劑量依賴性的藥物暴露增加。這些數(shù)據(jù)支持THB335進(jìn)入針對慢性自發(fā)性蕁麻疹的2期臨床試驗。
四川省醫(yī)藥保化品質(zhì)量管理協(xié)會組織召開
2025版《中國藥典》將于2025年10月..關(guān)于舉辦四川省藥品生產(chǎn)企業(yè)擬新任質(zhì)量
各相關(guān)企業(yè): 新修訂的《中華人..四川省醫(yī)藥保化品質(zhì)量管理協(xié)會召開第七
四川省醫(yī)藥保化品質(zhì)量管理協(xié)會第七..“兩新聯(lián)萬家,黨建助振興”甘孜行活動
為深入貫徹落實省委兩新工委、省市..學(xué)習(xí)傳達(dá)中央八項規(guī)定精神專題會議
2025年4月22日,協(xié)會黨支部組織召..關(guān)于收取2025年度會費的通知
各會員單位: 在過去的一年里,..四川省應(yīng)對新型冠狀病毒肺炎疫情應(yīng)急指
四川省應(yīng)對新型冠狀病毒肺炎疫情應(yīng)..四川省應(yīng)對新型冠狀病毒肺炎疫情應(yīng)急指
四川省應(yīng)對新型冠狀病毒肺炎疫情應(yīng)..