2月12日,中國國家藥監局藥品審評中心(CDE)官網最新公示顯示,諾和諾德(Novo Nordisk)申報的3.1類新藥司美格魯肽注射液新適應癥上市申請獲得受理,尚無具體適應癥信息披露。根據注冊分類及諾和諾德公開資料推測,這可能是司美格魯肽2.4mg注射劑(商品名為Wegovy),此前已經在中國獲批用于長期體重管理。本次該產品在中國申報上市的適應癥可能為用于低已確診心血管疾病的肥胖或超重成人的主要不良心血管事件(MACE)風險。
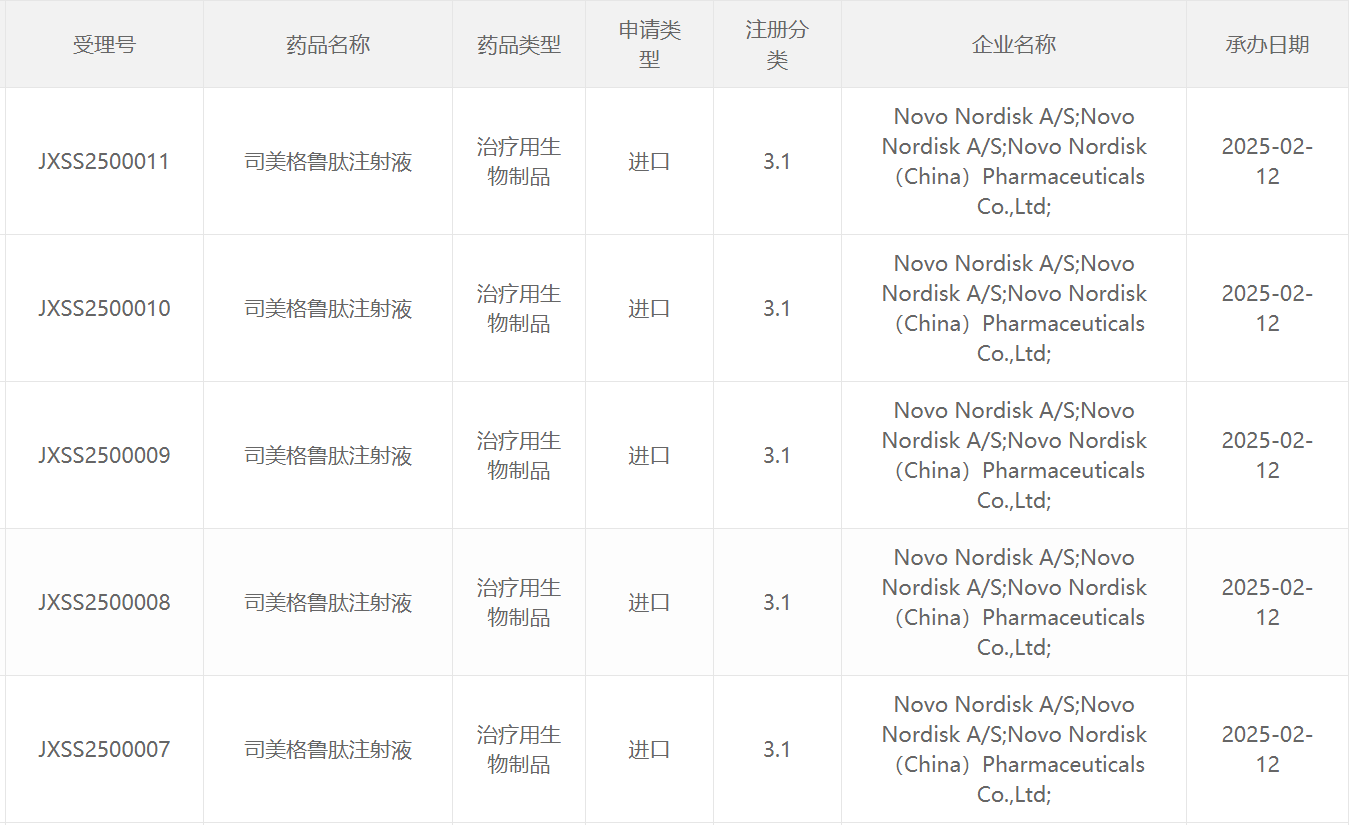
截圖來源:CDE官網
司美格魯肽是一種長效GLP-1類似物,它與天然GLP-1的氨基酸序列具有94%的同源性,能起到GLP-1受體激動劑的作用。
司美格魯肽注射液(Wegovy,2.4 mg)于2021年6月最早獲美國FDA批準用于治療普通肥胖患者,于2024年6月在中國獲批用于長期體重管理。2024年3月,Wegovy再次獲FDA批準,用于在超重或肥胖且已確診心血管疾病(CVD)的成人患者中降低主要不良心血管事件(MACE)的風險。此項批準基于SELECT心血管結局試驗,該研究在5年時間內評估司美格魯肽2.4mg和安慰劑結合標準治療在超重或肥胖且已確診CVD但無糖尿病病史的人群中預防MACE的療效。研究的主要目標是證實與安慰劑相比,司美格魯肽2.4mg在降低3點MACE(包括心血管死亡、非致死性心臟病發作[心肌梗死]或非致死性卒中)發病率方面的優效性。
SELECT研究數據此前已經發表于《新英格蘭醫學雜志》(NEJM)。該試驗表明:結合標準治療,Wegovy相較于安慰劑實現了20%的MACE風險降低,具有統計學意義。SELECT研究結果還表明:在長達5年的時間內,無論受試者基線年齡、性別、種族、民族、體質指數(BMI)和腎功能損害程度,均實現了MACE風險降低。
在全球范圍內,司美格魯肽注射液0.25、0.5和1.0mg(商品名為Ozempic)也已經獲美國FDA批準三項適應癥,分別用于:治療成人2型糖尿病;降低患有已知心臟病的成人2型糖尿病患者的主要心血管事件風險;降低腎臟疾病惡化、腎衰竭(終末期腎臟疾病)和心血管疾病導致的成人2型糖尿病和慢性腎臟疾病死亡的風險。
在中國,Ozempic已經獲NMPA批準用于治療成人2型糖尿病患者,以及用于降低伴有心血管疾病的2型糖尿病成人患者的主要心血管不良事件風險。此外,2024年8月,諾和諾德以生物制品2.2類申報的司美格魯肽注射液新適應癥上市申請也獲得NMPA受理,根據注冊分類可知該項適應癥為針對糖尿病腎病。
除了上述已在全球范圍內獲批的適應癥,司美格魯肽注射液還已經在多種適應癥方面取得新的進展,包括:
2024年11月,諾和諾德公布了3期ESSENCE試驗第一部分的最新研究結果。分析顯示,試驗達成了雙主要終點,與安慰劑相比,2.4 mg劑量的司美格魯肽注射液可顯著改善代謝功能障礙相關脂肪性肝炎(MASH)患者的肝纖維化,同時未加重脂肪性肝炎。62.9%實現了脂肪性肝炎緩解且肝纖維化無惡化,而安慰劑組在此數值上為34.1%。
2024年11月,諾和諾德宣布Ozempic用于治療患有外周動脈疾病(PAD)的2型糖尿病患者的3b期試驗達到主要終點。在試驗52周時,司美格魯肽與安慰劑相比患者在最大步行距離上顯著提升達13%,該結果具有臨床意義。根據此積極結果,諾和諾德預計將于2025年上半年在美國和歐盟遞交Ozempic擴展適應癥的監管申請。
2024年10月,一篇發布于知名期刊Alzheimer's & Dementia的研究指出,與其他糖尿病藥物相比,Ozempic與2型糖尿病(T2DM)患者確診為阿爾茨海默病(AD)風險降低40%-70%相關。這一發現支持Ozempic在神經退行性疾病中的進一步研究。
四川省醫藥保化品質量管理協會組織召開
2025版《中國藥典》將于2025年10月..關于舉辦四川省藥品生產企業擬新任質量
各相關企業: 新修訂的《中華人..四川省醫藥保化品質量管理協會召開第七
四川省醫藥保化品質量管理協會第七..“兩新聯萬家,黨建助振興”甘孜行活動
為深入貫徹落實省委兩新工委、省市..學習傳達中央八項規定精神專題會議
2025年4月22日,協會黨支部組織召..關于收取2025年度會費的通知
各會員單位: 在過去的一年里,..四川省應對新型冠狀病毒肺炎疫情應急指
四川省應對新型冠狀病毒肺炎疫情應..四川省應對新型冠狀病毒肺炎疫情應急指
四川省應對新型冠狀病毒肺炎疫情應..