2月12日,中國國家藥監(jiān)局藥品審評中心(CDE)官網(wǎng)公示顯示,再鼎醫(yī)藥申報的瑞普替尼膠囊擬納入優(yōu)先審評,適用于NTRK融合基因陽性實體瘤成人患者。公開資料顯示,瑞普替尼是靶向作用于ROS1致癌因子的新一代酪氨酸激酶抑制劑(TKI),再鼎醫(yī)藥擁有該產(chǎn)品在大中華區(qū)的獨家開發(fā)及商業(yè)化權。
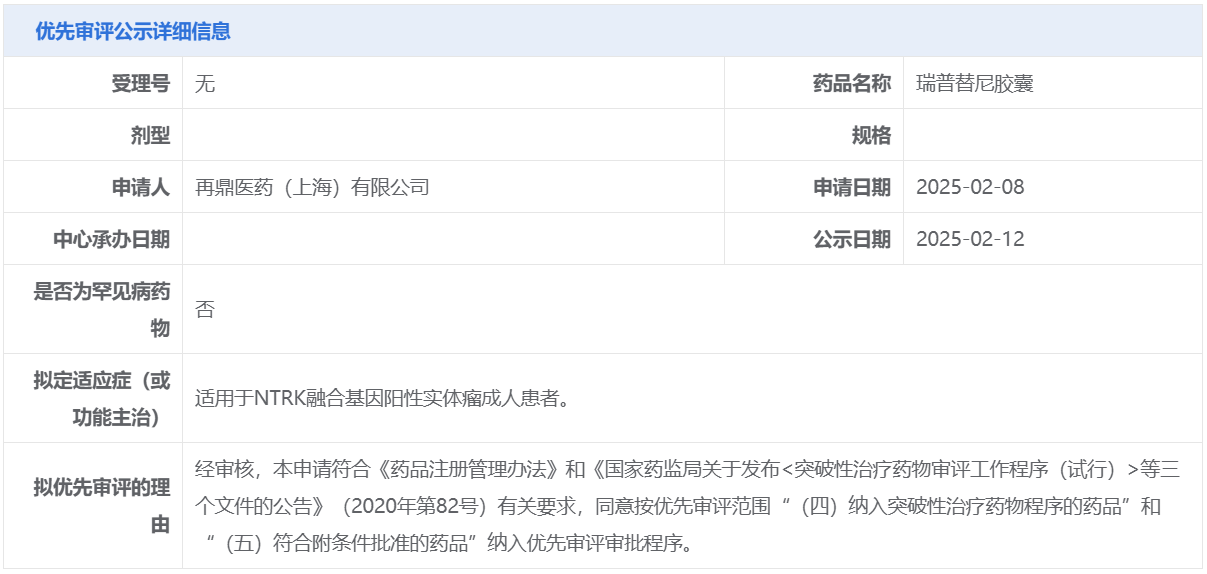
截圖來源:CDE官網(wǎng)
神經(jīng)營養(yǎng)酪氨酸受體激酶(NTRK)是一類參與神經(jīng)發(fā)育的受體。NTRK基因融合是當含有NTRK基因的染色體片段斷裂并與另一條染色體上的基因結合時發(fā)生的變異。這類融合導致異常蛋白質(zhì)的產(chǎn)生,從而可能導致癌細胞生長。
瑞普替尼(repotrectinib)最初由Turning Point公司(現(xiàn)已被百時美施貴寶收購)開發(fā),是一款ROS1和NTRK靶向抑制劑。它具有獨特的結構,與靶點蛋白的結合位點位于“ATP口袋”內(nèi),并且不受多種耐藥性突變的影響。因此,它能夠克服多種對其它TKI產(chǎn)生抗性的基因突變,殺死攜帶ROS1或NTRK基因融合的多種腫瘤細胞,有潛力治療ROS1陽性的NSCLC,以及ROS1、NTRK和ALK陽性的實體瘤。
瑞普替尼于2023年11月獲FDA批準用于局部晚期或轉(zhuǎn)移性ROS1陽性非小細胞肺癌(NSCLC)成人患者的治療,并于2024年5月獲中國NMPA批準上市,用于ROS1陽性的局部晚期或轉(zhuǎn)移性非小細胞肺癌成人患者。
2024年6月,美國FDA加速批準瑞普替尼用于治療NTRK基因融合陽性實體瘤成人患者和12歲及以上兒童患者。此次獲批是基于1/2期TRIDENT-1研究的結果,該研究評估了瑞普替尼在NTRK陽性成人實體瘤患者中的療效。
根據(jù)再鼎醫(yī)藥此前新聞稿介紹,TRIDENT-1研究納入了40名TKI初治患者和48名接受過TKI治療的患者,這些受試者患有NTRK陽性的局部晚期或轉(zhuǎn)移性實體瘤,涵蓋了15種不同類型的癌癥。再鼎醫(yī)藥參與了TRIDENT-1研究并負責該研究在大中華區(qū)的執(zhí)行。
TRIDENT-1研究結果顯示,在TKI初治患者中,中位隨訪時間為17.8個月,客觀緩解率(cORR)為58%,其中43%的患者達到部分緩解(PR),15%的患者達到完全緩解(CR)。在這些達到緩解的患者中,83%的患者在接受瑞普替尼治療一年后仍持續(xù)緩解,中位持續(xù)緩解時間(mDOR)尚未達到。在接受過TKI治療的患者中,中位隨訪時間為20.1個月,cORR為50%,其中50%的患者達到PR,沒有患者達到CR。此外,42%達成緩解的患者在接受瑞普替尼治療一年后仍持續(xù)緩解,mDOR為9.9個月。在基線時有可評估中樞神經(jīng)系統(tǒng)(CNS)轉(zhuǎn)移的患者中,2名TKI初治患者和3名接受過TKI治療的患者均觀察到顱內(nèi)緩解。
本次瑞普替尼針對NTRK融合基因陽性實體瘤適應證在中國擬納入優(yōu)先審評,意味著其有望在中國加速獲批。
四川省醫(yī)藥保化品質(zhì)量管理協(xié)會組織召開
2025版《中國藥典》將于2025年10月..關于舉辦四川省藥品生產(chǎn)企業(yè)擬新任質(zhì)量
各相關企業(yè): 新修訂的《中華人..四川省醫(yī)藥保化品質(zhì)量管理協(xié)會召開第七
四川省醫(yī)藥保化品質(zhì)量管理協(xié)會第七..“兩新聯(lián)萬家,黨建助振興”甘孜行活動
為深入貫徹落實省委兩新工委、省市..學習傳達中央八項規(guī)定精神專題會議
2025年4月22日,協(xié)會黨支部組織召..關于收取2025年度會費的通知
各會員單位: 在過去的一年里,..四川省應對新型冠狀病毒肺炎疫情應急指
四川省應對新型冠狀病毒肺炎疫情應..四川省應對新型冠狀病毒肺炎疫情應急指
四川省應對新型冠狀病毒肺炎疫情應..