2月11日,中國國家藥監局(CDE)官網最新公示顯示,葛蘭素史克(GSK)以生物制品2.2類申報的抗IL-5單抗美泊利珠單抗注射液上市申請獲得受理。根據GSK官網及公開資料推測,本次美泊利珠單抗在中國申報上市的適應癥可能為慢性阻塞性肺疾病(COPD)。針對該適應癥,美泊利珠單抗尚未在全球范圍內獲得批準。
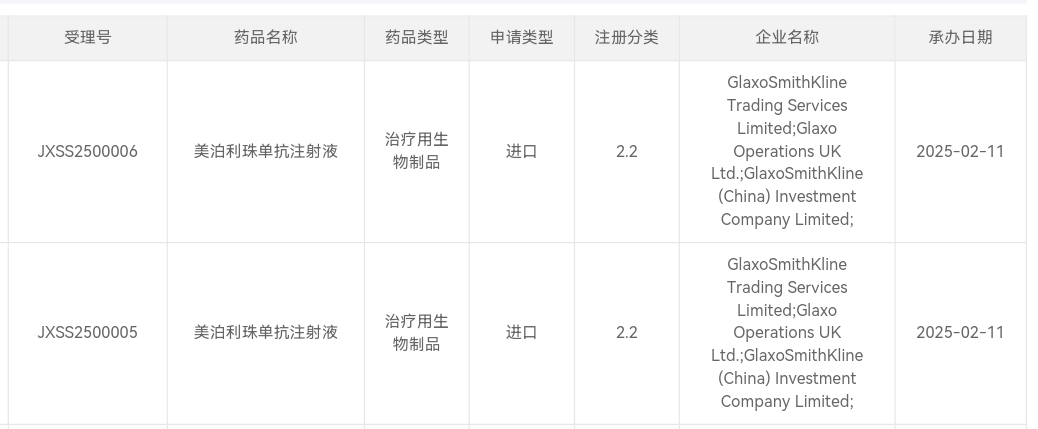
截圖來源:CDE官網
白細胞介素-5(IL-5)是一種細胞因子,能夠調節嗜酸性粒細胞的生長、活化、存活,并為嗜酸性粒細胞從骨髓遷移至肺部及其他器官提供重要信號。
公開資料顯示,美泊利珠單抗(mepolizumab)是全球首個獲批上市的抗IL-5單抗,其通過與IL-5結合,阻斷IL-5與嗜酸粒細胞表面受體結合,抑制嗜酸粒細胞的生物活性并使其數量持續降低至正常水平,從而減少嗜酸性粒細胞的生長,以及嗜酸粒細胞所介導的炎癥和組織損傷,維持健康狀態。
美泊利珠單抗已被開發用于治療一系列與2型炎癥相關的IL-5介導的疾病。在全球范圍內,該產品獲批的適應癥包括:作為6歲及以上嗜酸性粒細胞表型的嚴重哮喘患者的附加維持治療、作為慢性鼻竇炎合并鼻息肉(CRSwNP)和鼻皮質類固醇反應不足的成人患者的附加維持治療;治療成人嗜酸性肉芽腫病合并多血管炎(EGPA);治療12歲及以上的高嗜酸性粒細胞綜合征(HES)。而針對COPD適應癥,該產品尚未在全球范圍內獲得批準。
在中國,美泊利珠單抗最早于2021年獲NMPA批準,目前已經獲批3項適應癥,包括嗜酸性肉芽腫性多血管炎、重度嗜酸粒細胞性哮喘、慢性鼻竇炎伴鼻息肉。
2024年12月,GSK宣布,FDA已經接受美泊利珠單抗的新適應癥上市申請,作為嗜酸性粒細胞表型慢性阻塞性肺疾病(COPD)患者的附加維持治療,PDUFA日期為2025年5月7日。GSK新聞稿表示,如果獲批,美泊利珠單抗可能是首個獲批用于慢性阻塞性肺病患者每月給藥的生物制劑。
FDA接受美泊利珠單抗的新適應癥上市申請是依據MATINEE研究的數據,該研究評估了美泊利珠單抗在804例COPD患者中的有效性和安全性,這些患者有血液嗜酸性粒細胞計數為特征的2型炎癥證據。MATINEE研究通過在吸入維持治療中加入美泊利珠單抗達到了其主要終點,與安慰劑相比,在治療52-104周的患者中,實現了具有統計學意義和臨床意義的中度/重度惡化年化率的降低。
根據中國藥物臨床試驗登記與信息公示平臺官網,GSK也已經在中國登記開展了MATINEE研究,評估美泊利珠單抗作為輔助療法治療嗜酸性粒細胞相關且頻繁急性加重的COPD受試者的療效和安全性。該研究目前已經完成。在該研究中,美泊利珠單抗的給藥方式為通過安全型注射器(SS)每4周一次皮下注射。
四川省醫藥保化品質量管理協會組織召開
2025版《中國藥典》將于2025年10月..關于舉辦四川省藥品生產企業擬新任質量
各相關企業: 新修訂的《中華人..四川省醫藥保化品質量管理協會召開第七
四川省醫藥保化品質量管理協會第七..“兩新聯萬家,黨建助振興”甘孜行活動
為深入貫徹落實省委兩新工委、省市..學習傳達中央八項規定精神專題會議
2025年4月22日,協會黨支部組織召..關于收取2025年度會費的通知
各會員單位: 在過去的一年里,..四川省應對新型冠狀病毒肺炎疫情應急指
四川省應對新型冠狀病毒肺炎疫情應..四川省應對新型冠狀病毒肺炎疫情應急指
四川省應對新型冠狀病毒肺炎疫情應..