2月5日,CDE 官網公示,信達生物申報的「信迪利單抗注射液」和「伊匹木單抗注射液」擬被納入優先審評,適應癥為兩藥聯合用于可切除的微衛星高度不穩定型(MSI-H)或錯配修復缺陷型(dMMR)結腸癌患者的新輔助治療。
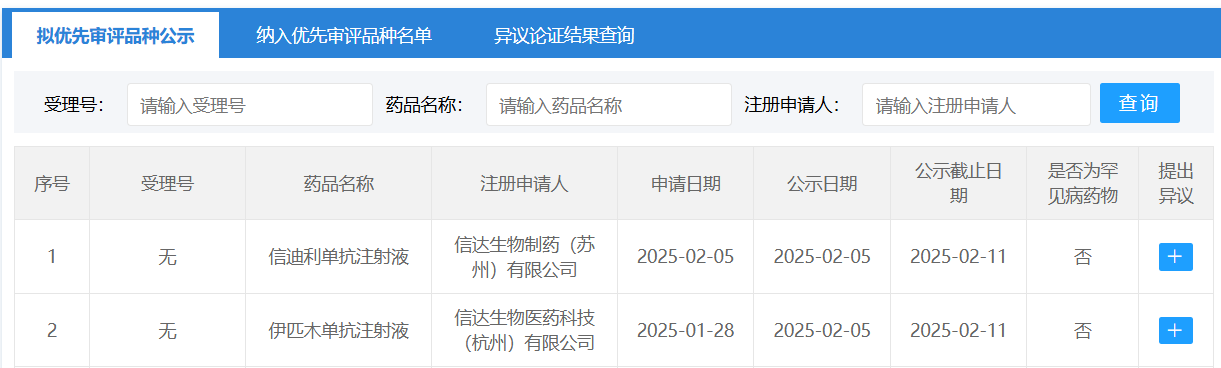
截圖來源:CDE 官網
信迪利單抗是一種 PD-1 抑制劑,已在國內獲批 8 項適應癥,涵蓋經典型霍奇金淋巴瘤、非鱗狀非小細胞肺癌、鱗狀非小細胞肺癌、肝細胞癌、食管鱗癌、胃及胃食管交界處腺癌、子宮內膜癌多個癌種。
伊匹木單抗(IBI310)是信達開發的一種抗 CTLA4 單抗,它能特異性結合 CTLA-4,從而阻斷 CTLA-4 介導的 T 細胞抑制,促進 T 細胞的激活和增殖,提高腫瘤免疫反應,達到抗腫瘤的效果。IBI310 尚未獲批,國內最高研發進度是 Ⅲ 期臨床。
本次擬納入優先審評的是這兩款藥物的聯合療法,適應癥是可切除的 MSI-H/dMMR 結腸癌患者的新輔助治療。
在 2024 年 6 月舉行的 ASCO 年會上,信達曾口頭報告了 IBI310 聯合信迪利單抗新輔助治療結腸癌的 Ib 期隨機對照研究臨床數據(研究登記號:NCT05890742)。該研究旨在評估 IBI310 聯合信迪利單抗對比信迪利單抗新輔助治療在可切除的 IIB-III 期的 MSI-H 或 dMMR 結腸癌受試者中的療效、安全性和耐受性。
Ib 期研究結果顯示:
截止 2024 年 2 月 4 日,101 名患者隨機入組,分別接受 IBI310 聯合信迪利單抗新輔助治療(n=52)和信迪利單抗新輔助治療 (n=49)。符合研究方案分析 (PP) 集中,IBI310 聯合信迪利單抗組病理完全緩解(pCR)率為 80.0%,顯著高于信迪利單抗單藥組的 47.7%。 安全性方面,IBI310 聯合信迪利單抗組和信迪利單抗單藥組中,導致手術延遲的藥物相關不良事件(TRAE)分別發生于 2 例(3.8%)和 0 例患者。3 級及以上的免疫相關不良事件(irAE)分別發生于 3 例(5.8%)和 4 例(8.2%)患者。IBI310 聯合信迪利單抗組未增加額外的安全性風險,并且對后續手術沒有影響。
基于這項研究數據,CDE 此前已將 IBI310 聯合信迪利單抗新輔助治療結腸癌納入了突破性治療藥物品種名單。
四川省醫藥保化品質量管理協會組織召開
2025版《中國藥典》將于2025年10月..關于舉辦四川省藥品生產企業擬新任質量
各相關企業: 新修訂的《中華人..四川省醫藥保化品質量管理協會召開第七
四川省醫藥保化品質量管理協會第七..“兩新聯萬家,黨建助振興”甘孜行活動
為深入貫徹落實省委兩新工委、省市..學習傳達中央八項規定精神專題會議
2025年4月22日,協會黨支部組織召..關于收取2025年度會費的通知
各會員單位: 在過去的一年里,..四川省應對新型冠狀病毒肺炎疫情應急指
四川省應對新型冠狀病毒肺炎疫情應..四川省應對新型冠狀病毒肺炎疫情應急指
四川省應對新型冠狀病毒肺炎疫情應..