近日,尚德藥緣宣布其 1 類新藥 ACT001 膠囊正式被 CDE 納入突破性治療,適應癥為經過一線治療或一線治療中出現腦部新發病灶或原腦轉移病灶進展的小細胞肺癌(SCLC)腦轉移患者。
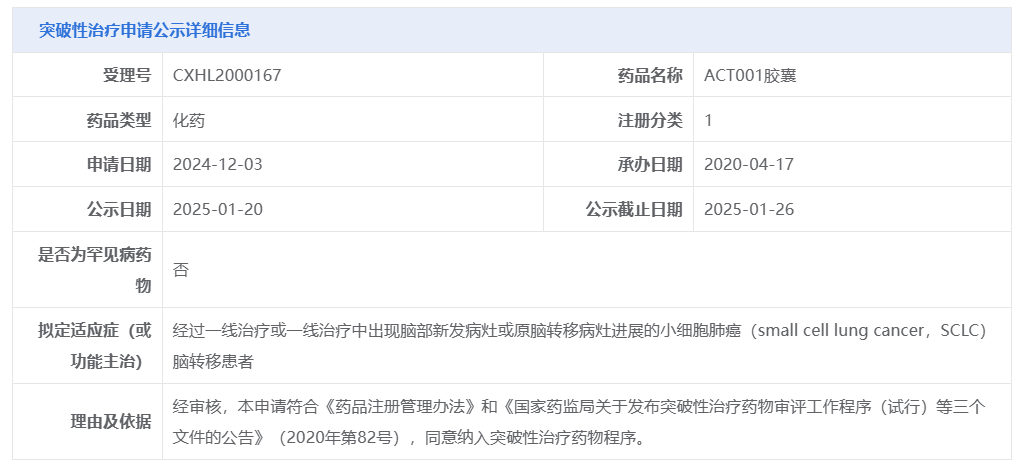
截圖來源:CDE 官網
據 Nature Review 報道,接近 20% 的癌癥患者遲早會發生腦轉移,其中肺癌尤其是小細胞肺癌患者腦轉移瘤的發生率最高。癌癥發生腦轉移往往意味著疾病進入終末期,很多開發中的新藥都刻意排除腦轉移瘤的受試者,癌癥腦轉移瘤的治療存在迫切的臨床需求,也是全球監管部門與醫生關注的世界醫學難題。
ACT001 是一種 NF-κB/STAT3 雙靶點抑制劑,曾獲得 FDA 授予快速通道資格,用于治療兒童彌漫性中線膠質瘤,包括但不限于彌漫性內生型橋腦膠質瘤。此外,該藥還獲得 FDA 授予了針對膠質母細胞瘤(GBM)的孤兒藥資格、針對攜帶 H3K27 突變的彌漫性中線膠質瘤的兒童罕見病資格,以及歐盟授予的針對 GBM 的孤兒藥資格。根據尚德藥緣新聞稿,本次突破性治療資格的獲得主要是依據「ACT001 聯合全腦放療治療肺癌腦轉移瘤的 Ⅱb/Ⅲ 期注冊臨床研究」,該臨床試驗的牽頭主要研究者是我國工程院院士、放射腫瘤學家、中國臨床腫瘤學會理事長于金明教授。2022 年 ASCO 上,尚德藥緣曾公布了 ACT001 和全腦放療 (WBRT) 治療實體瘤和腦轉移患者療效和安全性的 Ⅰ/Ⅱ 期臨床研究結果。該研究招募了 22 名 SCLC 患者、14 名 NSCLC 患者、7 名乳腺癌患者和 2 名其他癌癥患者。其中,NSCLC 患者的 EGFR、ALK 和 ROS1 突變為陰性,乳腺癌患者的 HER2 為陰性。所有受試者都完成了所需的 WBRT。截至 2021 年 12 月 31 日,隊列 C(安慰劑組)、A (ACT001 200 mg,每日兩次)和 B(ACT001 400mg,每日兩次) 中分別有 7、13 和 10 名患者接受了治療后 MRI 掃描。根據 iRANO 標準,隊列 C 中有 3 名患者(3/7,42.9%)、隊列 A 中有 11 名患者(11/13,84.6%)和隊列 B 中有 9 名患者(9/10,90.0%)出現顱內病變部分緩解。研究認為,ACT001 看起具有改善 WBRT 引起的不良事件并減少腫瘤轉移的顱內負擔的潛力。除了腫瘤適應癥,尚德藥緣還開展了 ACT001 針對特發性肺纖維化(IPF)與纖維化進展的間質性肺疾病(F-ILD)的澳洲 Ⅱ 期臨床試驗。該試驗已完成,并在 2023 年 9 月的歐洲呼吸學會年會上口頭報告了臨床試驗結果。該臨床試驗的患者平均年齡為 70 歲,入組前平均肺活量 FVC(%pred)為 75.2。數據顯示,ACT001 在 44 名 IPF 和 F-ILD 受試者中表現出了良好的耐受性,并在兩組患者中均產生了潛在的療效信號,試驗數據支持對 ACT001 做進一步的療效研究。
