使100%前列腺癌患者關鍵指標下降的TCE療法;受體占有率可達100%的動脈粥樣硬化療法… | 一周盤點
發布時間: 2025-01-14 來源: 藥明康德
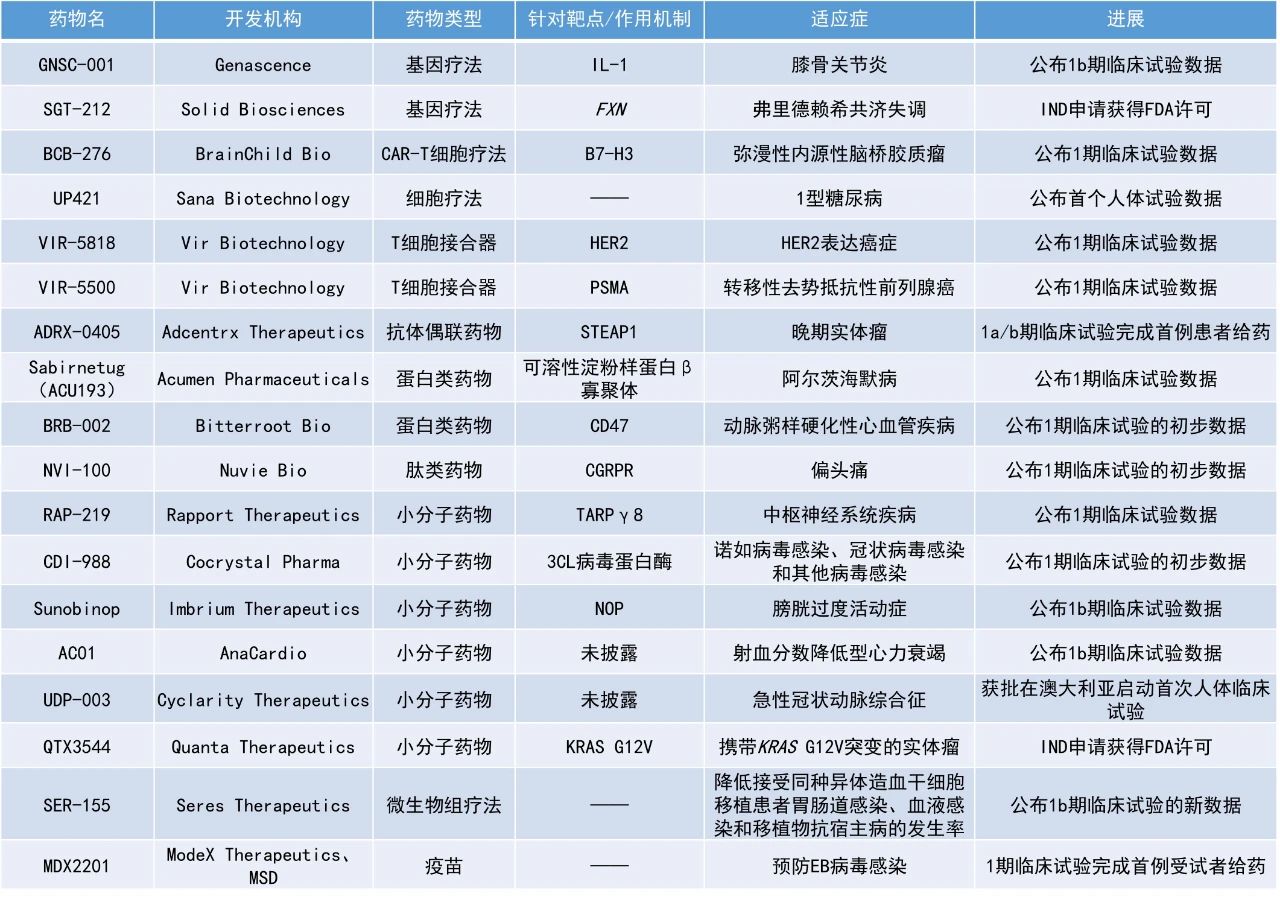
1. Vir Biotechnology旗下兩款T細胞接合器(TCE)VIR-5818與VIR-5500的初步1期臨床數據積極,在曾接受過多線治療的癌癥患者中觀察到早期臨床緩解的信號。其中,VIR-5500在治療前列腺癌患者的臨床試驗中讓100%患者的前列腺特異性抗原(PSA)指標產生下降。2. 用于治療動脈粥樣硬化的CD47靶向療法BRB-002在1期臨床試驗測試的最高劑量下,受體占有率(RO)可達100%。3. AMPA受體負變構調節劑RAP-219在一項1期臨床試驗中,給藥后的5天內就達到了臨床前模型中與最大療效相關的靶點RO(50%-70%),同時保持了與先前1期臨床試驗一致的差異化的耐受性特征。
藥明康德內容團隊整理
VIR-5818、VIR-5500:公布1期臨床試驗數據Vir Biotechnology公司公布了旗下兩款T細胞接合器VIR-5818與VIR-5500的初步1期臨床數據。VIR-5818、VIR-5500是分別靶向HER2、前列腺特異性膜抗原(PSMA)的TCE,均采用PRO-XTEN平臺所開發。TCE是一類強效抗腫瘤藥物,能夠引導免疫系統(特別是T細胞)殺死癌細胞。PRO-XTEN平臺的掩蔽技術旨在使TCE保持不活躍(掩蔽)狀態,直到其到達腫瘤微環境,在特定的腫瘤蛋白酶作用下去除掩蔽并激活,從而殺傷癌細胞。VIR-5818在一項1期臨床試驗中接受評估,旨在檢視其作為單藥的安全性和藥代動力學,以及與帕博利珠單抗聯合使用的效果。受試者包含多種HER2表達癌癥的患者,包括乳腺癌和結直腸癌(CRC)。初步療效數據顯示,接受≥400 µg/kg VIR-5818的患者中,50%(10/20)出現劑量依賴性腫瘤縮小。其中一些患者此前已接受多達9種治療方案。在HER2陽性CRC患者亞組中,觀察到強效抗腫瘤活性,這些患者已用盡標準治療手段。在該亞組中,33%(2/6)的患者在早期劑量下達到確認的部分緩解(cPR),其中一名患者在數據截止時持續cPR超過18個月。初步安全性數據顯示,VIR-5818整體耐受性良好,79名患者中僅出現輕度1級或2級細胞因子釋放綜合征(CRS),占比分別為20%和10%,未觀察到3級或更高等級的CRS。VIR-5500正在一項1期臨床試驗中接受評估,該研究旨在檢視其在轉移性去勢抵抗性前列腺癌(mCRPC)患者中的安全性、藥代動力學和初步療效。該研究已招募了18名具有顯著疾病負擔并接受過3至6線治療的患者。初步療效數據顯示,接受≥120 µg/kg初步劑量的患者中,100%(12/12)觀察到前列腺特異性抗原水平降低,58%(7/12)患者達到PSA50應答(即PSA水平降低50%)。安全性數據顯示,在劑量高達1000 µg/kg且未使用預防性皮質類固醇的情況下,未觀察到劑量限制性毒性。此外,僅觀察到輕度1級或2級CRS(分別為17%和11%),未出現3級或更高等級的CRS。Bitterroot Bio公司公布了BRB-002在健康受試者中開展的1期研究的積極結果。BRB-002是一種潛在“first-in-class”的免疫調節蛋白療法,用于治療動脈粥樣硬化性心血管疾病。該療法通過抑制細胞表面受體CD47("別吃我"信號),從而改善動脈粥樣硬化的根本原因,減輕炎癥斑塊的負擔。此次公布的結果顯示,BRB-002在所有測試劑量下都是安全的,沒有報告嚴重的不良事件。此外,觀察到CD47受體占有率的增加與劑量有關,在測試的最高劑量下,RO可達100%。在動脈粥樣硬化的臨床前模型中,CD47的RO為6-26%時,主動脈斑塊的負擔相對于對照組明顯減少。Rapport Therapeutics公司公布了RAP-219的正電子發射斷層掃描(PET)試驗和第二次多劑量遞增試驗(MAD-2)的結果。RAP-219是一種臨床階段的AMPA受體負變構調節劑,旨在通過選擇性靶向AMPA相關蛋白TARPγ8實現神經解剖學特異性。AMPA受體存在于整個大腦,包括小腦和腦干,它們的非選擇性靶向導致耐受性差。相比之下,TARPγ8在海馬和大腦皮層中表達豐富,在小腦和腦干中表達最少。RAP-219被設計為對TARPγ8具有高效力和選擇性。據觀察,它具有較長的半衰期(8-14天)和很小的藥物相互作用,使其非常適合多藥治療。與傳統的神經科學藥物相比,RAP-219有可能提供更好的活性、耐受性和更高的治療指數,從而為更多的患者提供持續的治療益處,而不會產生無法忍受的副作用。該公司目前正在尋求RAP-219作為局灶性癲癇、糖尿病周圍神經性疼痛和雙相躁狂患者的潛在差異化治療。此次公布的PET試驗數據表明,RAP-219在給藥后5天內就達到了先前臨床前模型中與最大療效相關的靶點RO(50%-70%),同時保持了與先前1期臨床試驗一致的差異化的耐受性特征。在MAD-2試驗中,觀察到RAP-219通常耐受性良好,與最初的MAD試驗相比,劑量滴定速度更快,暴露量更高。Sabirnetug(ACU193):公布1期臨床試驗數據Acumen Pharmaceuticals公司在Journal of Prevention of Alzheimer's Disease雜志上發表了1期臨床試驗INTERCEPT-AD的結果,該研究旨在評估sabirnetug(ACU193)在早期阿爾茨海默病(AD)患者中的安全性和耐受性。Sabirnetug是一種選擇性靶向毒性可溶性β淀粉樣蛋白寡聚體(AβOs)的人源化單克隆抗體。Sabirnetug能夠結合AβOs,由于其獨特的結合特性,sabirnetug有可能在產生淀粉樣蛋白相關成像異常(ARIA,一種抗淀粉樣蛋白抗體療法產生的常見主要副作用)風險較低的情況下提供治療益處,因為sabirnetug可以在不直接靶向淀粉樣斑塊的情況下阻斷AβOs的毒性作用。此次公布的結果顯示,sabirnetug的耐受性總體良好,其靶點作用和淀粉樣斑塊的減少具有劑量和暴露依賴性,支持sabirnetug在早期AD治療方面的持續開發。此前公布的結果表明,sabirnetug對AβOs具有選擇性、劑量依賴性的靶點作用,在較高劑量組中,淀粉樣斑塊的減少具有統計學意義,且ARIA-E(水腫)的總體水平較低。Quanta Therapeutics公司宣布,美國FDA批準了其多KRAS抑制劑QTX3544的IND申請,可以針對攜帶KRAS G12V突變的實體瘤患者啟動1期臨床試驗。QTX3544是一種口服的、偏好G12V突變、同時作用于KRAS活性(ON)和非活性(OFF)狀態的KRAS抑制劑。該公司同時宣布,其用于評估另一種KRAS抑制劑QTX3046與西妥昔單抗的聯用效果的1期臨床試驗已啟動組合治療部分。QTX3046是一種口服的選擇性KRAS G12D別構抑制劑,它可以同時作用于KRAS的ON和OFF狀態。
