1. 泛RAS抑制劑RMC-6236在攜帶RAS突變或野生型RAS的晚期實體瘤患者中展現出令人鼓舞的抗腫瘤活性和安全性,攜帶任意RAS突變的胰腺導管腺癌(PDAC)患者的6個月生存率達97%。
2. 在腫瘤激活T細胞接合器(TRACTr)JANX007治療晚期或轉移性去勢抵抗性前列腺癌(mCRPC)患者的1a期臨床試驗中,100%的患者達到PSA 50(PSA水平下降≥50%)標準。
3. 在一項早期臨床試驗中,DFP-17729聯用TS-1作為晚期胰腺癌患者三線或三線以上治療,與對照治療相比能夠顯著延長患者的中位總生存期(OS)近3個月。
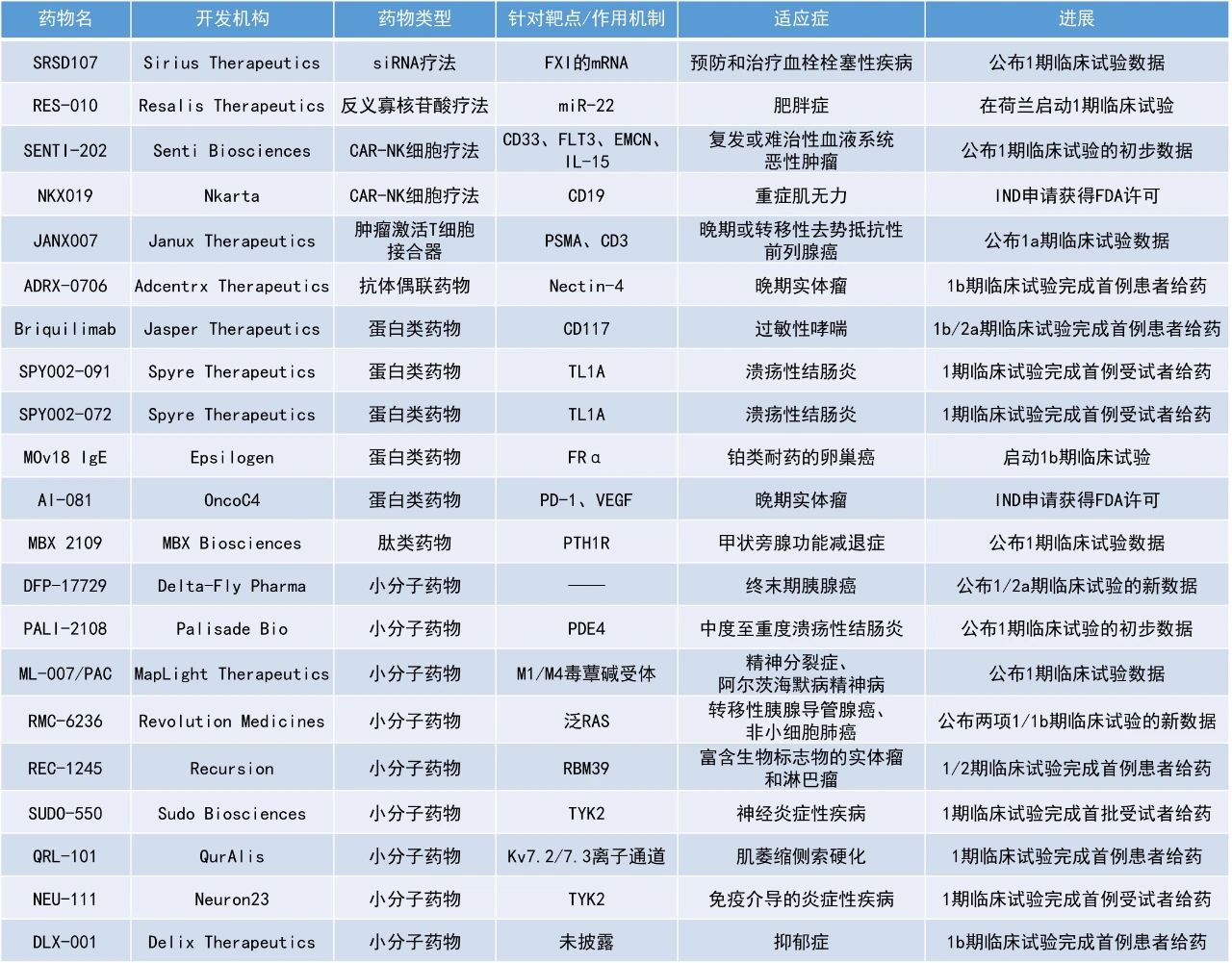
RMC-6236:公布兩項1/1b期臨床試驗的新數據Revolution Medicines公司公布了其在研泛RAS抑制劑RMC-6236的最新臨床結果。RMC-6236是一款口服、可靶向突變和野生型RAS在GTP結合(具活性,ON)狀態下的選擇性抑制劑。此次公布的1/1b期多中心、開放標簽、劑量遞增和劑量擴展研究RMC-6236-001旨在評估RMC-6236作為單藥治療攜帶RAS突變或野生型RAS晚期實體瘤患者的效果。分析顯示,RMC-6236單藥作為轉移性PDAC患者二線療法時顯示出顯著療效,支持3期臨床試驗RASolute 302的持續推進,具體數據如下:
-
KRAS G12X突變患者(n=22):中位無進展生存期(PFS)為8.8個月(95% CI:8.5個月–不可估計[NE]),中位OS仍不可估計(95% CI:NE–NE)。
-
任意RAS突變患者(n=37):中位PFS為8.5個月(95% CI:5.9個月–NE),中位OS仍不可估算(95% CI:8.5個月–NE)。
-
6個月生存率:KRAS G12X突變患者為100%,任意RAS突變患者為97%。
-
客觀緩解率(ORR):KRAS G12X突變患者為36%,任意RAS突變患者為27%。
RMC-6236在經治NSCLC患者中的表現同樣亮眼。截至2024年9月30日,最新數據涵蓋了124名攜帶RAS突變的經治NSCLC患者,這些患者接受了每日一次120至300毫克的RMC-6236治療。在此劑量范圍內,RMC-6236展現良好的耐受性。在40名二線或三線NSCLC患者(這些患者既往接受過免疫療法和鉑類化療,但未接受多西他賽)中,中位PFS為9.8個月(95% CI:6–12.3個月),中位OS為17.7個月(95% CI:13.7個月–NE),ORR為38%。Janux Therapeutics公司公布了在研療法JANX007的積極中期臨床數據。JANX007目前正在針對晚期或轉移性去勢抵抗性前列腺癌患者進行的1a期臨床試驗中接受評估。JANX007是一款靶向前列腺特異性膜抗原(PSMA)的腫瘤激活T細胞接合器,分別靶向PSMA和T細胞表面表達的CD3受體。它的設計讓JANX007在腫瘤微環境中經過蛋白酶切割而被激活,從而在降低了其潛在毒性的同時,最大化抗腫瘤免疫反應。截至2024年11月15日的數據,共有16名患者以每周一次的給藥方案接受2-9 mg的目標劑量治療。在所有劑量組中均觀察到了高比例的PSA應答率和顯著的PSA水平下降:100%的患者達到PSA 50標準,63%的患者達到PSA 90,31%的患者達到PSA 99。在目標劑量≥2 mg時,PSA下降具有持久性:75%的患者在≥12周內維持PSA 50,50%的患者在≥12周內維持PSA 90。不論患者的耐藥驅動基因狀態或是否接受過紫杉烷類藥物或其它藥物治療,均觀察到了深度且持久的PSA應答。在可按RECIST評估的患者中,觀察到抗腫瘤活性,50%(4/8)的患者出現確認或未確認的部分緩解。安全性方面,JANX007耐受性良好,細胞因子釋放綜合征(CRS)及CRS相關的不良事件主要局限于治療第一個周期,且為1級和2級。同樣,與治療相關的不良事件(TRAEs)主要也局限于第一個周期,且為1級和2級。目前尚未達到JANX007的最大耐受劑量。DFP-17729:公布1/2a期臨床試驗的新數據Delta-Fly Pharma公司宣布,DFP-17729聯用TS-1或TS-1單藥作為晚期胰腺癌患者的三線后治療的2/3期臨床試驗已獲日本醫藥品醫療器械綜合機構(PMDA)批準。DFP-17729是一種新型方法,旨在中和酸性的腫瘤微環境。該公司首先評估了DFP-17729作為難治性胰腺癌的治療方法,未來將尋求把其適應癥擴展到其他類型的癌癥。在針對晚期胰腺癌患者的1/2期研究中,與對照治療(TS-1或吉西他濱)相比,接受DFP-17729聯用TS-1作為三線或三線以上治療超過6周的患者的中位OS有顯著延長(9.0個月對比6.1個月)。此外,在接受DFP-17729治療的胰腺癌患者中,尿液堿化與中位OS之間存在顯著相關性,可作為關鍵的概念驗證。MBX Biosciences公司宣布在The Journal of Clinical Endocrinology and Metabolism雜志上發表了其候選療法MBX 2109的1期研究結果。MBX 2109是其基于精確內分泌肽(PEP)平臺開發的甲狀旁腺激素(PTH)多肽前藥,能夠以一周一次的給藥頻率,提供長效的PTH活性,旨在作為治療甲狀旁腺功能減退癥(HP)的潛在長效激素替代療法。此藥物于2022年7月獲得美國FDA的孤兒藥資格,用于治療HP。此次公布的結果顯示,MBX 2109的前藥和活性藥物的半衰期均較長,分別為79-95小時和184-213小時,支持每周一次的給藥頻率。每周給藥后,藥物在體內的濃度變化相對平穩,峰谷比值根據給藥劑量的不同在1.47到1.79之間。此外,觀察到與劑量成正比增加的白蛋白調整后的血清鈣濃度以及內源性PTH(1-84)的抑制,這與健康受試者中預期的PTH藥理學效果一致。安全性方面,MBX 2109重復給藥在所有測試劑量下通常耐受性良好,大多數不良反應輕微,最常見的問題是注射部位反應,沒有報告與藥物劑量相關的嚴重不良事件或死亡。Resalis Therapeutics公司宣布啟動RES-010的首次人體1期研究。RES-010是一種靶向脂質生物合成、線粒體功能和脂肪組織轉化的主要調節因子miR-22的反義寡核苷酸(ASO)療法,旨在重編程代謝途徑,對肥胖和脂肪肝疾病具有持久的疾病緩解治療作用。臨床前研究表明,RES-010能減少脂肪量、保持瘦體重并增強能量消耗。RES-010以減少身體各部位(包括內臟和肝臟)的脂肪為目標,有望補充和增強現有抗肥胖藥物(如GLP-1受體激動劑)的療效,支持可持續的長期體重管理。1期臨床試驗將在健康、超重和中度肥胖受試者中探索RES-010的安全性、耐受性、藥代動力學、藥效學和療效。Sirius Therapeutics公司宣布,其用于預防和治療血栓栓塞性疾病的下一代小干擾RNA(siRNA)療法SRSD107的1期臨床試驗的初步數據將在第66屆美國血液學會(ASH)年會上公布。SRSD107是該公司開發的新型雙鏈siRNA,特異性靶向編碼人凝血因子XI(FXI)的mRNA并抑制FXI蛋白表達,從而阻斷內在凝血途徑并促進抗凝/抗血栓作用。此次公布的結果顯示,SRSD107具有良好的安全性和有效性,可以預防血栓形成事件,并且不會增加出血風險,有望為需要慢性抗凝劑的患者提供只需每半年一次甚至每年一次的治療。該公司計劃在未來幾個月內開始2期研究。
