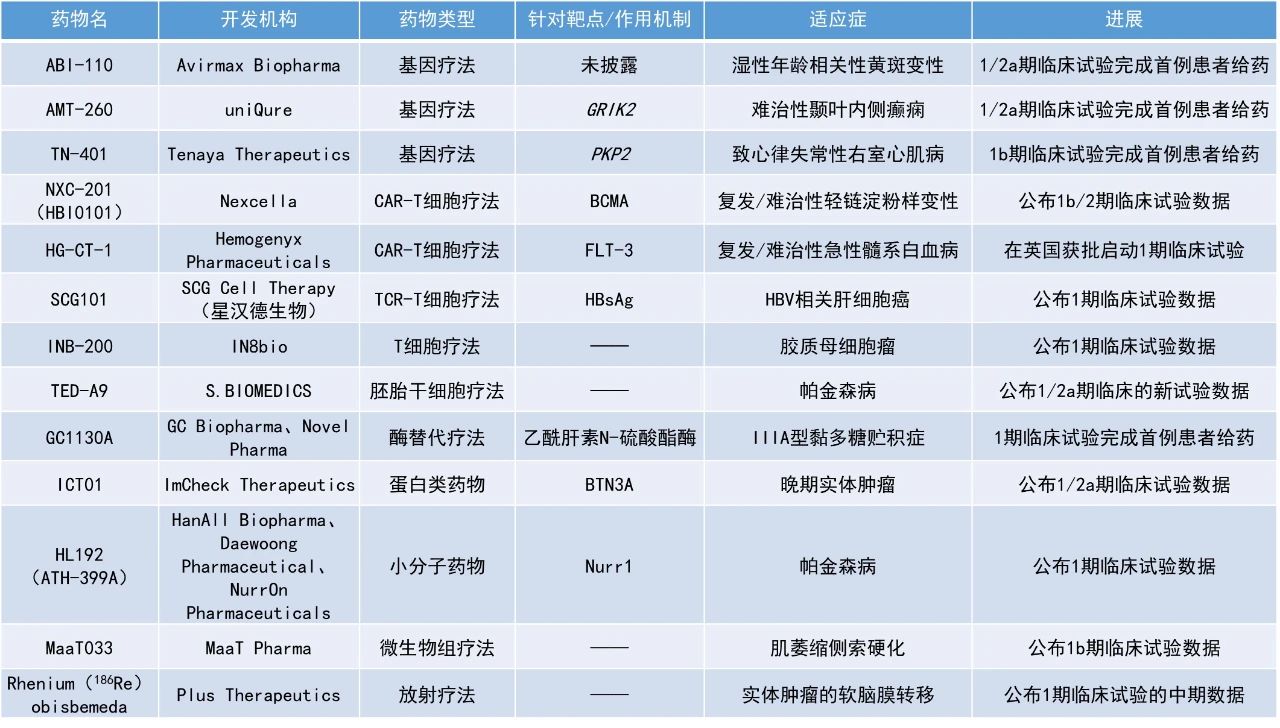
1. γ9δ2 T細(xì)胞激活劑ICT01聯(lián)用阿扎胞苷和維奈托克治療新確診的老年和/或不適合標(biāo)準(zhǔn)治療的急性髓系白血病(AML)患者,總完全緩解(CR)率達(dá)75%。
2. 治療實(shí)體瘤軟腦膜轉(zhuǎn)移(LM)的放射治療藥物Rhenium(186Re)obisbemeda與標(biāo)準(zhǔn)的外照射放療相比,可使中樞神經(jīng)系統(tǒng)(CNS)蛛網(wǎng)膜下腔吸收的輻射劑量提高多達(dá)8倍。
3. 細(xì)胞療法TED-A9在治療帕金森病的1/2a期臨床試驗(yàn)中表現(xiàn)亮眼,高劑量組所有3名患者的步態(tài)凍結(jié)癥狀完全消失。
藥明康德內(nèi)容團(tuán)隊(duì)整理
ICT01:公布1/2a期臨床試驗(yàn)數(shù)據(jù)ImCheck Therapeutics公司公布了其新型γ9δ2 T細(xì)胞激活劑ICT01聯(lián)用阿扎胞苷和維奈托克治療新確診的老年和/或不適合標(biāo)準(zhǔn)治療的AML患者的積極1/2a期臨床試驗(yàn)數(shù)據(jù)。γ9δ2 T細(xì)胞是先天免疫系統(tǒng)的一部分,負(fù)責(zé)對(duì)腫瘤和感染的免疫監(jiān)察。ICT01是一款靶向嗜乳脂蛋白家族成員BTN3A的單克隆抗體療法,通過與BTN3A結(jié)合,它可以選擇性地激活γ9δ2 T細(xì)胞,并且促進(jìn)它們遷移和浸潤腫瘤,進(jìn)一步激發(fā)CD8陽性T細(xì)胞和自然殺傷細(xì)胞的抗腫瘤反應(yīng)。截至2024年7月19日的數(shù)據(jù),16名療效可評(píng)估患者的中位隨訪時(shí)間為4.0個(gè)月(范圍0.7-7.4個(gè)月),總CR率為75%,CR/伴有血液學(xué)不完全恢復(fù)的完全緩解(CRi)率為94%。第1、2、3和4個(gè)治療周期結(jié)束時(shí)達(dá)到CR/CRi的患者比例分別為44%、81%、88%和94%。總體而言,緩解持續(xù)時(shí)間為2.5個(gè)月,截至數(shù)據(jù)截止日期患者仍然在持續(xù)緩解。中位總生存期數(shù)據(jù)尚未成熟。Rhenium(186Re)obisbemeda:公布1期臨床試驗(yàn)的中期數(shù)據(jù)Plus Therapeutics公司公布了其主打放射治療藥物Rhenium(186Re)obisbemeda治療實(shí)體瘤軟腦膜轉(zhuǎn)移的臨床試驗(yàn)ReSPECT-LM的最新數(shù)據(jù)。該療法是一款新型可注射放療藥物,專門配制用于以安全、有效和方便的方式在CNS腫瘤中遞送專一靶向的高劑量輻射,以優(yōu)化患者臨床結(jié)局。由于186Re的半衰期短,具有破壞癌組織的β放射能和可用于活體成像的γ放射能,是CNS治療應(yīng)用的理想放射性同位素。20名患者接受了治療,包括9名原發(fā)癌癥為乳腺癌的患者,5名原發(fā)癌癥為非小細(xì)胞肺癌的患者,以及6名原發(fā)癌癥為其他癌癥的患者。此次公布的結(jié)果顯示,治療后112天時(shí),93%(14/15)患者的腦脊液循環(huán)腫瘤細(xì)胞(CTC)顯示有緩解,包括1例CR和1例疾病穩(wěn)定(SD)。磁共振成像(MRI)結(jié)果顯示,75%(12/16)的患者獲得緩解或SD,包括5例緩解和7例SD。臨床應(yīng)答結(jié)果顯示,86%(12/14)的患者獲得緩解或SD,包括2例部分緩解(PR)和10例SD。隊(duì)列1-4組患者的中位總生存期為9個(gè)月,16名患者中有6人在分析時(shí)仍存活。此外,有3名患者在“同情使用”項(xiàng)目下接受了3次給藥,這3名患者的生存時(shí)間均超過400天,其中1名患者甚至超過了30個(gè)月。新聞稿還指出,與標(biāo)準(zhǔn)的外照射放療相比,該治療方法可使CNS蛛網(wǎng)膜下腔吸收的輻射劑量提高多達(dá)8倍。TED-A9:公布1/2a期臨床的新試驗(yàn)數(shù)據(jù)
S.BIOMEDICS公司宣布了其細(xì)胞療法TED-A9在治療帕金森病的1/2a期臨床試驗(yàn)中的首批6名受試者的1年隨訪數(shù)據(jù)。TED-A9是一款通過對(duì)人類胚胎干細(xì)胞(hESC)進(jìn)行小分子化合物處理而生成的高度純化中腦多巴胺能祖細(xì)胞。通過外科手術(shù),hESC衍生的多巴胺能祖細(xì)胞被移植到患者雙側(cè)殼核的前、中、后部。移植后,這些細(xì)胞將成熟為多巴胺能神經(jīng)元,通過增強(qiáng)帕金森病患者的神經(jīng)連接,有望恢復(fù)患者的運(yùn)動(dòng)功能。
此次公布的結(jié)果顯示,根據(jù)Hoehn和Yahr量表,低劑量組(n=3)患者的運(yùn)動(dòng)癥狀平均改善了19.4%,而高劑量組(n=3)改善了44.4%,表明疾病狀態(tài)從嚴(yán)重轉(zhuǎn)向較輕。步態(tài)凍結(jié)(帕金森病患者常見的運(yùn)動(dòng)癥狀之一)在低劑量組的部分患者(1/2)中完全消失,在高劑量組的所有患者(3/3)中完全消失。神經(jīng)影像技術(shù)結(jié)果顯示,由移植細(xì)胞形成的突觸中多巴胺轉(zhuǎn)運(yùn)蛋白(DAT)增加,高劑量組更為明顯。安全性方面,沒有觀察到與移植細(xì)胞相關(guān)的問題。INB-200:公布1期臨床試驗(yàn)的新數(shù)據(jù)
IN8bio公司公布其耐化療的轉(zhuǎn)基因自體γδ T細(xì)胞療法INB-200加入到膠質(zhì)母細(xì)胞瘤患者的替莫唑胺(TMZ)維持治療中的1期臨床試驗(yàn)數(shù)據(jù)。INB-200是一種強(qiáng)大的協(xié)同治療方法,能在患者接受化療時(shí)持續(xù)存在,并保持其識(shí)別和殺死癌細(xì)胞的能力。此次公布的結(jié)果顯示,92%接受INB-200協(xié)同治療的可評(píng)估患者的無進(jìn)展生存期(PFS)超過了接受標(biāo)準(zhǔn)治療(Stupp方案)患者的中位PFS(6.9個(gè)月),大多數(shù)患者的PFS超過了基于年齡和腫瘤MGMT狀態(tài)預(yù)測的PFS。此外,5名患者仍然存活,3名患者已返回工作崗位,其中1名患者在治療后40.5個(gè)月時(shí)疾病仍然沒有進(jìn)展。活檢結(jié)果顯示,兩名患者在接受INB-200治療后,腦腫瘤微環(huán)境中持續(xù)存在著γδ T細(xì)胞以及CD3陽性和CD8陽性T細(xì)胞。安全性方面,任何隊(duì)列中均未報(bào)告與治療相關(guān)的嚴(yán)重不良事件、劑量限制性毒性(DLT)、細(xì)胞因子釋放綜合征(CRS)、輸注反應(yīng)或免疫效應(yīng)細(xì)胞相關(guān)神經(jīng)毒性(ICAN)。最常見的治療相關(guān)不良事件是1-2級(jí)毒性,包括與標(biāo)準(zhǔn)護(hù)理TMZ相關(guān)的白細(xì)胞和血小板計(jì)數(shù)下降。SCG101:公布1期臨床試驗(yàn)數(shù)據(jù)
星漢德生物(SCG Cell Therapy)公布了其自主研發(fā)的乙型肝炎病毒(HBV)特異性T細(xì)胞受體(TCR)-T細(xì)胞療法SCG101的1期臨床試驗(yàn)的新數(shù)據(jù)。SCG101是一種靶向乙型肝炎病毒表面抗原(HBsAg)的特異性自體TCR-T細(xì)胞療法。星漢德生物依托自主研發(fā)的獨(dú)有GianT技術(shù)平臺(tái),篩選高親力且高活性的天然TCR,可以有效靶向?qū)嶓w腫瘤中通過主要組織相容性復(fù)合體(MHC)表達(dá)的細(xì)胞內(nèi)抗原。臨床前和臨床研究數(shù)據(jù)顯示,SCG101具有腫瘤抑制和HBV共價(jià)閉合環(huán)狀DNA(cccDNA)根除作用,可實(shí)現(xiàn)抗腫瘤和抗病毒功能。此次公布的結(jié)果顯示,SCG101在晚期HBV相關(guān)肝細(xì)胞癌(HCC)患者中顯示出有希望的抗病毒活性。在接受單次靜脈注射5.0×10^7-1.0×10^8個(gè)TCR-T細(xì)胞/kg劑量的SCG101治療的12名患者中,所有患者的血清HBsAg水平均顯著下降,其中11名患者(92%)的HBsAg水平下降了1.0-4.6 log10,并且在整個(gè)長達(dá)一年的隨訪期間,這些患者的HBsAg水平保持在100 IU/mL以下。值得注意的是,有4名患者(33%)在接受單次SCG101輸注后的21天內(nèi)實(shí)現(xiàn)了HBsAg的消失,并且這種狀態(tài)持續(xù)了一整個(gè)隨訪期。SCG101的安全性總體上良好,治療耐受性良好。最常見的治療相關(guān)不良事件包括暫時(shí)性的肝酶升高、發(fā)熱、細(xì)胞減少癥、CRS、低白蛋白血癥和低鈉血癥。HL192(ATH-399A):公布1期臨床試驗(yàn)數(shù)據(jù)HanAll Biopharma公司、Daewoong Pharmaceutical公司和NurrOn Pharmaceuticals公司成功完成了HL192(ATH-399A)的1期研究。HL192(ATH-399A)是一種用于治療帕金森病的Nurr1激活劑,此前已在健康受試者中完成了一項(xiàng)1期研究。此次公布的結(jié)果顯示,該研究在5個(gè)不同的劑量組中達(dá)到了安全性和耐受性的主要終點(diǎn),表明在治療這種使人衰弱的神經(jīng)系統(tǒng)疾病方面邁出了有意義的一步。HL192(ATH-399A)的耐受性良好,76名受試者均無重大安全問題。接受治療的患者與接受安慰劑的患者在治療伴發(fā)不良事件上的發(fā)生率相當(dāng),沒有明確的劑量依賴性趨勢(shì)。藥代動(dòng)力學(xué)結(jié)果支持每天一次的給藥方案。MaaT033:公布1b期臨床試驗(yàn)數(shù)據(jù)MaaT Pharma公司宣布,其評(píng)估MaaT033在肌萎縮側(cè)索硬化(ALS)患者中療效的1b期臨床試驗(yàn)IASO已達(dá)到主要終點(diǎn)。ALS患者連續(xù)服用MaaT033兩個(gè)月后顯示出良好的安全性和耐受性。初步的微生物組分析證實(shí)了MaaT033已成功移植,進(jìn)一步支持了其安全性和耐受性結(jié)果。MaaT033是一種源自供體、高濃度、高多樣性的口腔微生物群生態(tài)系統(tǒng)療法(Microbiome Ecosystem Therapy),目前正作為一種輔助療法進(jìn)行開發(fā),以提高接受造血干細(xì)胞移植(HSCT)和其他細(xì)胞療法的患者的總生存率。此前,MaaT033已被歐洲藥品管理局(EMA)授予孤兒藥資格。
