1. Cue Biopharma公司公布了其兩款新型生物制品的積極臨床數(shù)據(jù),其中接受CUE-101聯(lián)用PD-1抑制劑pembrolizumab一線治療的HPV陽性復(fù)發(fā)性/轉(zhuǎn)移性頭頸部鱗狀細胞癌(R/M HNSCC)患者12個月時的總生存率為91.3%。
2. 胸苷酸合成酶抑制劑NUC-3373聯(lián)用pembrolizumab在一項臨床研究中使1名尿路上皮膀胱癌患者的靶病灶縮小了100%。
3. 用于治療慢性乙肝病毒(HBV)感染的表觀遺傳沉默劑TUNE-401在新西蘭獲批進入1b期臨床試驗。
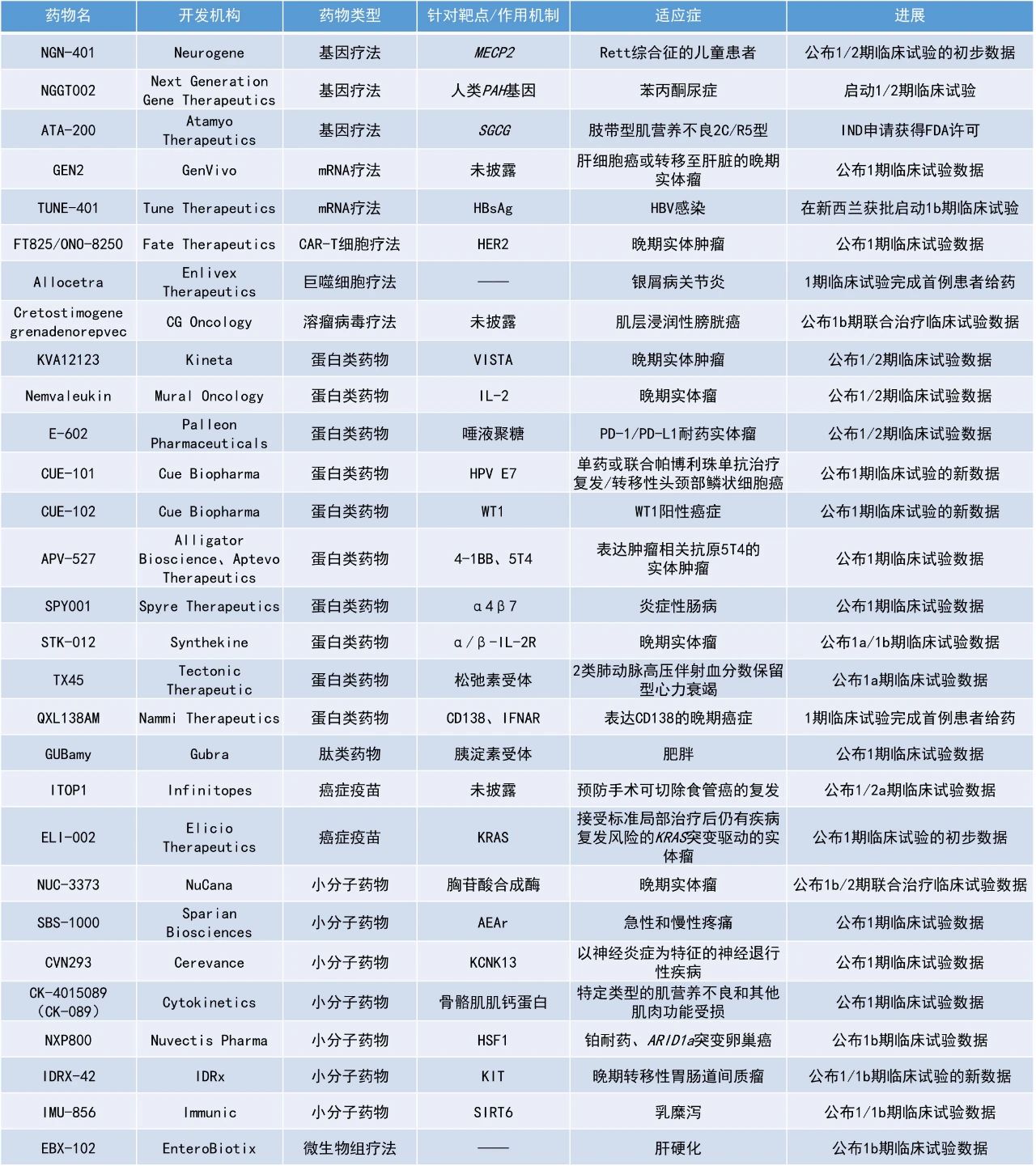
CUE-101、CUE-102:公布1期臨床試驗的新數(shù)據(jù)Cue Biopharma公司公布其CUE-101治療頭頸癌和CUE-102治療WT1陽性癌癥的1期臨床試驗的積極新數(shù)據(jù)。CUE-101是該公司開發(fā)的一款基于白細胞介素-2(IL-2)的T細胞誘導(dǎo)劑,旨在選擇性調(diào)節(jié)和激活HPV陽性T細胞,以提高療效,同時減少傳統(tǒng)免疫療法的副作用。CUE-102是一種由兩個呈遞WT1肽的人白細胞抗原(HLA)分子、四個親和力減弱的IL-2分子和一個效應(yīng)減弱的人免疫球蛋白G(IgG1)Fc結(jié)構(gòu)域組成的新型生物制品,被開發(fā)作為單一療法治療WT1陽性復(fù)發(fā)/轉(zhuǎn)移性癌癥患者。截至2024年9月11日的數(shù)據(jù),接受CUE-101聯(lián)用PD-1抑制劑pembrolizumab一線治療的HPV陽性R/M HNSCC患者的客觀緩解率(ORR)為46%,疾病控制率(DCR)為75%,12個月時的總生存率為91.3%,中位總生存期(OS)為21.8個月。在歷史研究KEYNOTE-048中,pembrolizumab單藥治療的ORR為19%,12個月時的總生存率為51%,中位OS為12.3個月。在本研究中,1例患者達到完全緩解(CR),10例患者達到部分緩解(PR),以及7例患者獲得了超過12周的持久疾病穩(wěn)定(SD)。接受該一線聯(lián)合治療的PD-L1低表達患者的ORR為50%。截至2024年10月29日的數(shù)據(jù),接受CUE-102單藥治療的晚期胰腺癌患者的DCR為67%,其中包括腫瘤負荷減少40%的未確認的PR。有證據(jù)表明,WT1特異性CD8陽性T細胞受到了選擇性刺激和擴增,而非特異性CD8陽性T細胞的總數(shù)沒有明顯增加。NUC-3373:公布1b/2期聯(lián)合治療臨床試驗數(shù)據(jù)NuCana公司公布了其正在進行的1b/2期模塊化研究的初步數(shù)據(jù),模塊1研究評估了NUC-3373聯(lián)用PD-1抑制劑pembrolizumab治療晚期實體瘤患者的療效,模塊2研究評估了NUC-3373聯(lián)用多西他賽治療肺癌患者的療效。NUC-3373是一種胸苷酸合成酶抑制劑,由核苷類似物5-氟尿嘧啶衍生而來,可導(dǎo)致DNA損傷。模塊1包括12名患有各種實體瘤、已用盡所有其他治療方案的患者,其中9例患者曾接受過PD-1/PD-L1抑制劑的治療。接受NUC-3373聯(lián)用pembrolizumab治療后,患者實現(xiàn)了顯著的腫瘤體積縮小,PFS得到延長。2名患者獲得了確認的PR,4例患者達到SD。在療效可評估人群中,ORR為22%,DCR為67%。其中,1例尿路上皮膀胱癌患者接受聯(lián)合治療后靶病灶縮小了100%(非靶病灶依然存在),1例BRAF突變轉(zhuǎn)移性皮膚黑色素瘤患者的靶病灶縮小了81%。此外,NUC-3373聯(lián)合pembrolizumab的耐受性普遍良好。模塊2包括4名非小細胞肺癌(NSCLC)或胸膜間皮瘤患者,這些患者在既往含化療方案中出現(xiàn)疾病進展或無法耐受。患者在接受NUC-3373聯(lián)用多西他賽治療后PFS得到延長,2例患者實現(xiàn)了長期的SD。Tune Therapeutics公司宣布,該公司已獲得新西蘭藥品和醫(yī)療器械安全局(Medsafe)的臨床試驗申請(CTA)批準(zhǔn),將推進其用于治療慢性HBV感染的表觀遺傳沉默劑TUNE-401進入1b期臨床試驗。TUNE-401是一款潛在"first-in-class"的表觀遺傳沉默劑,利用Tune Therapeutics的多功能、模塊化TEMPO平臺所開發(fā)。TUNE-401通過脂質(zhì)納米顆粒(LNP)將編碼活性、HBV靶向的RNA直接遞送至肝細胞。在這些細胞內(nèi),所遞送的RNA被翻譯為表觀沉默蛋白,靶向整合入宿主細胞的乙肝病毒DNA(intDNA)和共價閉合環(huán)狀DNA(cccDNA)。cccDNA是一種獨特、游離的環(huán)狀染色體(episomes),可作為病毒進行復(fù)制時的模板,是造成HBV患者多年持續(xù)感染的原因之一。臨床醫(yī)生認為,關(guān)閉這些cccDNA“病毒工廠”是實現(xiàn)HBV功能性治愈的必要前提。TUNE-401不涉及切割或編輯DNA,其導(dǎo)致產(chǎn)生的活性表觀沉默蛋白通過添加甲基基團與DNA結(jié)合,以抑制或失活病毒基因,同時保持人類基因的完整性。根據(jù)新聞稿,TUNE-401是首個獲批進入臨床,用以治療常見傳染病的表觀遺傳療法。KVA12123:公布1/2期臨床試驗數(shù)據(jù)Kineta公司公布了其正在進行的1/2期臨床試驗的最新進展,該試驗評估了其新型在研VISTA阻斷免疫療法KVA12123單藥或與PD-1抑制劑pembrolizumab聯(lián)用在晚期實體瘤患者中的治療效果。KVA12123是一種單克隆抗體療法,需每周輸注兩次。通過將獨特的表位與優(yōu)化的IgG1 Fc區(qū)相結(jié)合,KVA12123單藥在臨床前模型中顯示出強大的腫瘤生長抑制作用,且在臨床試驗中沒有報告細胞因子釋放綜合征(CRS)。KVA12123已被證明能降低VISTA靶點的風(fēng)險,并提供了一種新的方法來解決腫瘤微環(huán)境中的免疫抑制問題,其作用機制與以T細胞為重點的療法不同且互補。截至2024年10月18日的數(shù)據(jù),接受KVA12123單藥治療并至少進行了一次隨訪掃描的19例患者中,有13名實現(xiàn)了SD。在許多接受KVA12123單藥治療的患者中觀察到持久的臨床結(jié)果,其中1名此前已接受過六線治療(包括免疫檢查點抑制劑治療)的NSCLC患者已保持SD狀態(tài)60周。在接受KVA12123聯(lián)合pembrolizumab治療并至少進行了一次隨訪掃描的9例患者中,1例粘液表皮樣癌患者獲得了PR,靶病灶縮小了54%,非靶病灶獲得了CR;1名免疫檢查點抑制劑治療后進展的腎細胞癌患者達到SD,靶病灶縮小了24%。安全性方面,KVA12123的耐受性良好,單藥或與pembrolizumab聯(lián)用在任何劑量水平上都未出現(xiàn)劑量限制性毒性(DLT)。IDRX-42:公布1/1b期臨床試驗的新數(shù)據(jù)IDRx公司公布了其用于治療晚期胃腸道間質(zhì)瘤(GIST)的在研口服小分子KIT酪氨酸激酶抑制劑IDRX-42的1/1b期臨床試驗數(shù)據(jù)。IDRX-42旨在選擇性地靶向最常見的KIT突變形式,這些突變要么驅(qū)動腫瘤細胞的初始生長、增殖和生存,要么使腫瘤對現(xiàn)有療法產(chǎn)生耐藥性。截至2024年9月30日的數(shù)據(jù),87例中位治療線數(shù)為四線、療效可評估患者的ORR為29%,包括1例CR和24例PR。接受IDRX-42作為二線治療患者的ORR為53%(8/15),包括1例CR和7例PR,這些患者的中位PFS尚未達到。接受IDRX-42作為三線治療的患者的中位PFS估計為12.9個月。既往未使用過ripretinib、接受IDRX-42作為≥四線治療的患者在推薦的1b期劑量下,其中位PFS估計為11.0個月。此外,IDRX-42具有良好的安全性,在推薦的1b期劑量下,8%的患者減少了劑量,沒有因治療伴發(fā)不良事件而停藥的情況。APV-527:公布1期臨床試驗數(shù)據(jù)Alligator Bioscience公司和Aptevo Therapeutics公司公布了APV-527用于治療可能表達腫瘤抗原5T4實體瘤患者的1期臨床試驗數(shù)據(jù)。APV-527是一種靶向4-1BB和腫瘤抗原5T4的雙特異性抗體,僅在與4-1BB和5T4同時結(jié)合時才有活性。此次公布的結(jié)果顯示,16例療效可評估的患者中有9例(56%)達到SD,其中,1例結(jié)腸癌患者已保持SD超過6個月。最長的SD持續(xù)時間發(fā)生在一名乳腺癌患者中,該患者進入研究時病情發(fā)生進展,目前病情保持穩(wěn)定,且已參與研究超過11個月。安全性方面,APV-527在所有隊列中均表現(xiàn)出積極的安全性和耐受性,尚未觀察到嚴重的肝毒性。肝毒性是其他4-1BB靶向治療的常見副作用,可導(dǎo)致患者停藥。ELI-002:公布1期臨床試驗的初步數(shù)據(jù)Elicio Therapeutics公司公布了其在研治療性癌癥免疫療法ELI-002用于治療接受標(biāo)準(zhǔn)局部治療后仍有疾病復(fù)發(fā)風(fēng)險的KRAS突變驅(qū)動實體瘤的1期臨床試驗的初步結(jié)果。ELI-002由AMP修飾的KRAS突變體(mKRAS)肽段,和一種AMP修飾的免疫刺激寡核苷酸佐劑ELI-004組成,經(jīng)皮下給藥靶向淋巴結(jié)。它能產(chǎn)生RAS特異性殺傷性T細胞,以攻擊術(shù)后殘留腫瘤細胞,有望延長癌癥患者緩解并可預(yù)防未來復(fù)發(fā)。初步數(shù)據(jù)表明,靶向KRAS突變體的T細胞反應(yīng)持久且呈劑量依賴性,并誘導(dǎo)了針對患者特異性新抗原的反應(yīng)。觀察到無病生存期(DFS)與T細胞反應(yīng)強度之間存在相關(guān)性。此外,ELI-002的1期安全性及耐受性特征依然良好,未觀察到DLT或CRS。GUBamy:公布1期臨床試驗數(shù)據(jù)Gubra公司公布了長效胰淀素(amylin)類似物GUBamy在單劑量遞增(SAD)1期臨床試驗中獲得的積極結(jié)果。GUBamy耐受性良好,表現(xiàn)出良好的藥代動力學(xué)特征,半衰期為11天,支持每周一次的給藥方案。此外,單劑量的GUBamy劑量依賴性地降低體重,這一效果在試驗期間(6周)內(nèi)持續(xù)存在。在所有高劑量組(3.5-6.0 mg)中,受試者在6周試驗期內(nèi)的平均體重下降約3%,而安慰劑組的體重平均增長約1%。
