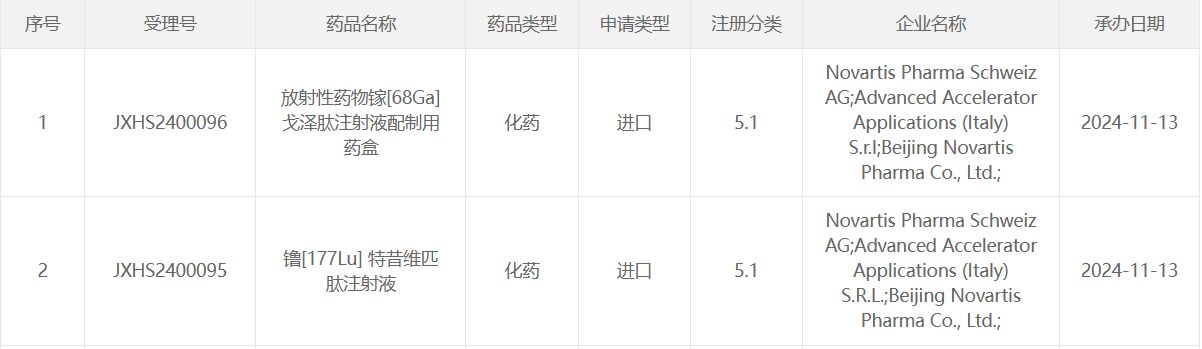
諾華重磅核藥治療前列腺癌
今日,諾華的镥 [177Lu] 特昔維匹肽上市申請獲 CDE 受理。
此前該藥已被 CDE 納入優先審評,適用于治療前列腺特異性膜抗原(PSMA)陽性轉移性去勢抵抗性前列腺癌(mCRPC) 、已接受雄激素受體通路抑制和紫杉類化療的成年患者。該藥是 FDA 批準的首個針對去勢抵抗性前列腺癌患者的靶向放射性配體療法,本次是在國內首次報上市。
镥 [177Lu] 特昔維匹肽(177Lu-PSMA-617)是一款 PSMA 靶向放射性配體療法,其將 PSMA-617 與發射β射線的 177Lu 連接在一起,與表達 PSMA 的前列腺癌細胞結合后,177Lu 釋放的輻射能量會輻射并殺死腫瘤細胞。
2022 年 3 月,镥 [177Lu] 特昔維匹肽被 FDA 批準用于治療接受過雄激素受體(AR)抑制劑和紫杉烷類化療治療的 PSMA 陽性成人轉移性去勢抵抗性前列腺癌(mCRPC),商品名為 Pluvicto。
Pluvicto 是 FDA 批準的首款用于治療這類 mCRPC 患者的靶向放射配體療法,其獲批是基于關鍵性 III 期臨床試驗 VISION 的積極結果。
Pluvicto 上市后第二年(2023 年)銷售額就達到 9.8 億美元,同比增速高達 263%。諾華最新三季報顯示,2024 年前三季度,銷售額已達 10.41 億美元。以放射配體療法為代表的核藥是諾華重金布局的領域。
科笛生物鹽酸米諾環素泡沫劑獲批上市
近日,NMPA 官網顯示,科笛生物「鹽酸米諾環素泡沫劑」在國內獲批上市,適用于 9 歲及以上兒童和成人患者的非結節性中度至重度尋常痤瘡炎癥性病變的局部治療。
據科笛生物公開信息顯示,CU-10201(外用 4% 米諾環素泡沫劑)是全球首個亦是唯一一個獲批用于尋常痤瘡治療的外用米諾環素。CU-10201 在中國的 III 期注冊性臨床試驗是一項多中心、隨機、雙盲、安慰劑對照的試驗,以評估 CU-10201 對中國九歲或以上中度至重度尋常痤瘡患者的療效及安全性。
該臨床試驗結果顯示,在療效方面,受試者在治療 12 周后,CU-10201 組炎性皮損的改善顯著優于安慰劑組,差異具有統計學意義 (P<0.001),達到主要終點指標。此外,基于研究者整體評估 (IGA) 評分的成功率,12 周治療后 CU-10201 組非炎性皮損的改善均顯著優于安慰劑組,差異具有統計學意義 (P<0.05),達到次要終點指標。
安全性方面,CU-10201 組受試者對給藥部位局部耐受性良好。CU-10201 組與安慰劑組不良事件的總體發生率相似,沒有發生與藥物相關的嚴重不良事件 (TESAE)。
四川省醫藥保化品質量管理協會組織召開
2025版《中國藥典》將于2025年10月..關于舉辦四川省藥品生產企業擬新任質量
各相關企業: 新修訂的《中華人..四川省醫藥保化品質量管理協會召開第七
四川省醫藥保化品質量管理協會第七..“兩新聯萬家,黨建助振興”甘孜行活動
為深入貫徹落實省委兩新工委、省市..學習傳達中央八項規定精神專題會議
2025年4月22日,協會黨支部組織召..關于收取2025年度會費的通知
各會員單位: 在過去的一年里,..四川省應對新型冠狀病毒肺炎疫情應急指
四川省應對新型冠狀病毒肺炎疫情應..四川省應對新型冠狀病毒肺炎疫情應急指
四川省應對新型冠狀病毒肺炎疫情應..