1. 口服選擇性FGFR3靶向療法TYRA-300的早期臨床結果亮眼,接受劑量≥90 mg/天的FGFR3突變轉移性尿路上皮癌(mUC)患者的疾病控制率(DCR)為100%。
2. 泛RAS抑制劑RMC-6236在經治胰腺導管腺癌(PDAC)患者中展現出令人鼓舞的抗腫瘤活性和安全性,攜帶任意RAS突變的PDAC患者在6個月的總生存率為91%。
3. 治療轉移性透明細胞腎細胞癌(ccRCC)的小分子HIF-2a抑制劑casdatifan在一項1/1b期臨床試驗中的DCR達81%。
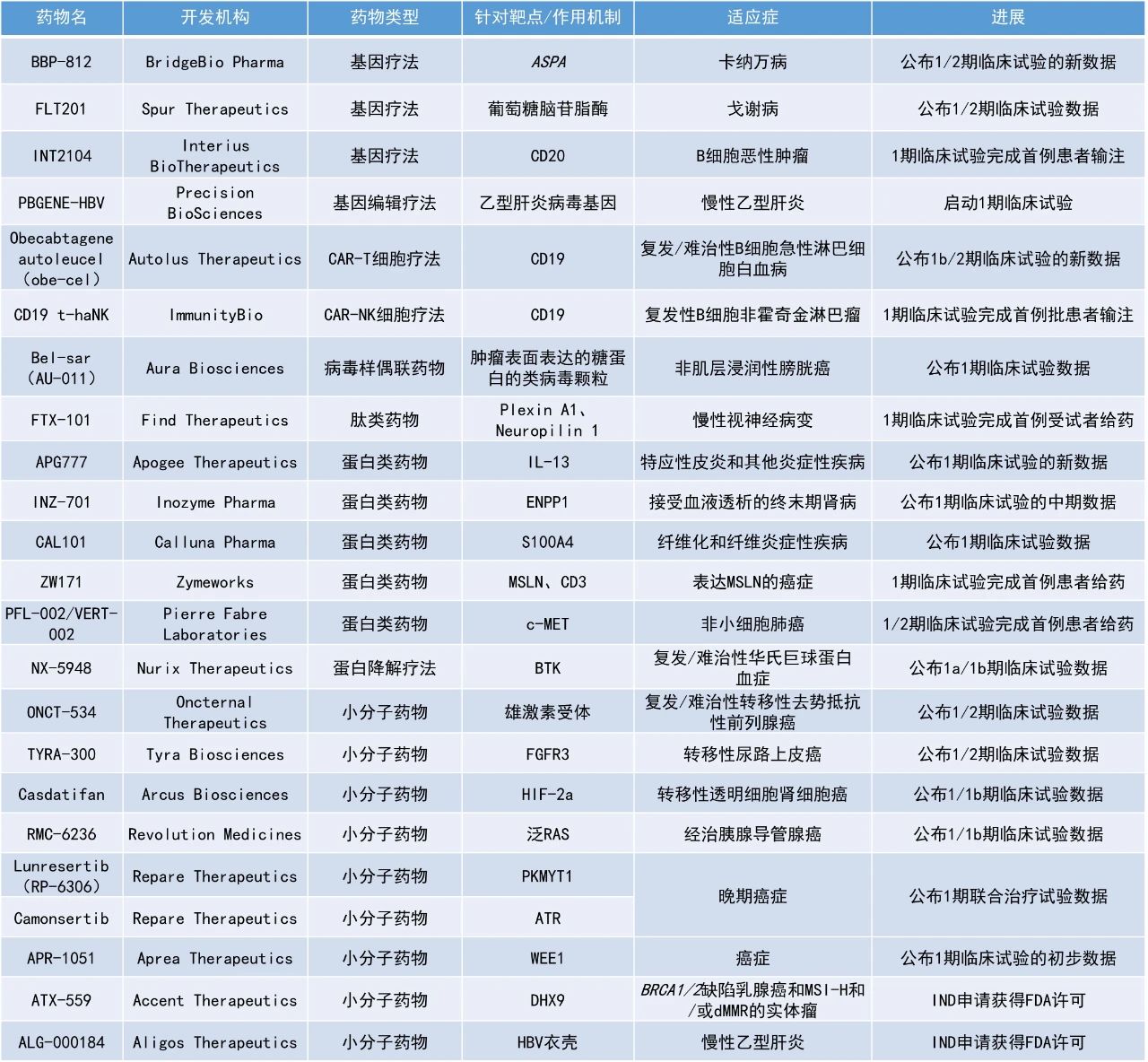
Tyra Biosciences公司公布了其潛在“first-in-class”的口服療法TYRA-300治療轉移性尿路上皮癌(mUC)患者的1/2期研究SURF301的數據。TYRA-300是一種FGFR3選擇性抑制劑,旨在避免抑制FGFR1、FGFR2和FGFR4時產生的毒性,且無論是否存在與耐藥性相關的FGFR3門衛(gatekeeper)突變都能發揮作用。截至2024年8月15日的數據,接受劑量≥90 mg/天的FGFR3突變mUC患者的DCR為100%,54.5%(6/11)的患者達到部分緩解(PR),其中3例仍在治療中,接受90 mg/天劑量的患者中有50%(5/10)達到PR。安全性方面,TYRA-300的耐受性總體良好,FGFR2和FGFR1相關毒性不常見。Revolution Medicines公司宣布,其在研泛RAS抑制劑RMC-6236在經治胰腺導管腺癌患者中展現出令人鼓舞的抗腫瘤活性和安全性。RMC-6236是一款口服、可靶向突變和野生型RAS在GTP結合(具活性,ON)狀態下的選擇性抑制劑。此次公布的1/1b期多中心、開放標簽、劑量遞增和劑量擴展研究RMC-6236-001旨在評估RMC-6236作為單藥治療攜帶RAS突變或野生型RAS晚期實體瘤患者的效果。結果顯示,RMC-6236單藥作為二線療法可改善攜帶任意RAS突變PDAC患者的中位無進展生存期(PFS)與總生存期(OS)。在二線治療中,攜帶KRAS G12X突變(KRAS G12X指的是KRAS蛋白第12位的甘氨酸因為基因突變,轉換成其它氨基酸)的PDAC患者的中位PFS為8.5個月,中位OS為14.5個月。攜帶任意RAS突變的PDAC患者在二線治療中的中位PFS為7.6個月,中位OS為14.5個月。攜帶KRAS G12X突變與攜帶任意RAS突變的PDAC患者在6個月時的總生存率分別為89%與91%。在二線治療組中,攜帶KRAS G12X突變患者的客觀緩解率(ORR)為29%,在三線及以上治療組(3L+)中為22%,這些患者的DCR分別為91%和89%。目前該療法的3期臨床試驗RASolute 302正在進行中。Arcus Biosciences公司公布了其在研小分子HIF-2a抑制劑casdatifan治療轉移性透明細胞腎細胞癌的1/1b期臨床試驗數據。HIF-2a是一種致癌轉錄因子,參與多個器官和腫瘤中的氧感應。由于VHL通路的基因異常,ccRCC幾乎普遍與HIF-2a失調有關。通過選擇性抑制HIF-2a,casdatifan可使一系列涉及腫瘤增殖和存活、耐藥性和血管生成的通路失效,從而導致癌細胞死亡。截至2024年8月30日的數據,中位隨訪時間為11個月。在100 mg每日劑量擴展隊列(n=32)中,DCR達81%,ORR為34%(2個待確認的緩解),許多患者仍在接受治療。安全性方面,casdatifan具有可接受且可管理的安全性。Nurix Therapeutics公司公布其在研蛋白降解劑NX-5948在治療復發/難治性華氏巨球蛋白血癥(WM)患者的1a/1b期臨床試驗中的最新數據。NX-5948是一種口服、可穿越血腦屏障的小分子布魯頓氏酪氨酸激酶(BTK)蛋白降解劑。Nurix此前報告稱,NX-5948對一系列對現有BTK抑制劑耐藥的腫瘤細胞系表現出高效的抑制活性,這對于經過大量前期治療的B細胞惡性腫瘤患者群體尤為重要。截至2024年10月10日的數據,在9例可評估應答的患者中,7例患者(77.8%)出現客觀緩解,兩例患者病情穩定(22.2%)。所有7例緩解均在8周的首次評估中觀察到,其中5例患者仍在接受治療,2例患者的治療時間超過一年。不論患者基線MYD88和CXCR4的突變狀態如何,均觀察到應答。Bel-sar(AU-011):公布1期臨床試驗數據Aura Biosciences公司宣布,其在研病毒樣偶聯藥物(VDC)bel-sar(AU-011)在治療非肌層浸潤性膀胱癌(NMIBC)患者的1期臨床試驗中獲得積極早期數據。Bel-sar由靶向腫瘤表面表達的糖蛋白的類病毒顆粒(VLP)與可由光激活的細胞毒性藥物偶聯生成。它被設計為具有雙重作用機制,既能誘導腫瘤細胞壞死,又能激發強大且持久的抗腫瘤免疫反應。該試驗共納入了13名患者,主要終點是評估bel-sar單獨使用(n=5)和bel-sar結合光激活(n=8)局部給藥的安全性和可行性。次要終點是評估生物活性及腫瘤微環境(TME)中的免疫介導變化。13名研究參與者中,10名為低級別疾病患者,另外3名為高級別疾病患者。在接受bel-sar結合光激活治療的患者(n=8)中,5名低級別疾病患者中有4名在組織病理學評估中顯示無腫瘤細胞殘留,達到了臨床完全緩解(CR)。3名高級別疾病患者中有2名在膀胱鏡檢查中顯示腫瘤明顯縮小。Oncternal Therapeutics公司公布了其在研雄激素受體(AR)抑制劑ONCT-534治療復發性或難治性轉移性去勢抵抗性前列腺癌(mCRPC)患者的1/2期研究的最新數據。ONCT-534在前列腺癌模型中對未發生突變的AR以及多種形式的AR突變和異常都具有活性。ONCT-534具有治療對AR通路抑制劑耐藥(包括AR擴增、AR配體結合域突變或AR配體結合域缺失型剪接變體)的mCRPC患者的潛力。截至2024年9月30日的數據,每天兩次的給藥方案耐受性良好,沒有出現與治療相關的3級或更高級別的毒性反應。1名患者在接受每日兩次160 mg劑量ONCT-534治療后,前列腺特異性抗原(PSA)升高,但在隨后4周以每日兩次300 mg劑量ONCT-534治療后,PSA下降了50%,同時計算機斷層掃描(CT)顯示與基線相比,靶病灶減少了16%。循環腫瘤細胞(CTCs)的計數和生物標志物分析顯示,在另外6名患者中,ONCT-534對AR調控基因的表達和AR的核轉位有令人鼓舞的效果。Lunresertib+camonsertib:公布1期聯合治療試驗數據Repare Therapeutics公司公布了1期臨床試驗MYTHIC的最新數據,該試驗評估了其PKMYT1抑制劑lunresertib和口服小分子ATR抑制劑camonsertib(lunre+camo)的組合療法。在這項分析中,Repare公司對接受2期段推薦劑量(RP2D)的患者進行了約9個月的隨訪。結果顯示,lunre+camo在保持臨床療效的同時,成功地減輕了與抗腫瘤藥物機制相關的貧血。此外,在這些患者中未觀察到任何級別的血小板減少或嚴重的中性粒細胞減少。Accent Therapeutics公司宣布美國FDA已批準其潛在“first-in-class”的DHX9抑制劑ATX-559的IND申請,可在實體瘤患者中開展1期研究,重點關注BRCA1/2缺陷的乳腺癌和微衛星不穩定性高(MSI-H)和/或錯配修復缺陷(dMMR)的實體瘤,預計首例患者將在2024年第四季度接受給藥。DHX9是一種DNA/RNA螺旋酶,據報道在復制、轉錄、翻譯、RNA剪接、RNA處理以及維持基因穩定性等方面發揮著重要作用,該酶是一個有吸引力的新腫瘤學靶點。ATX-559通過抑制DHX9可利用關鍵的腫瘤弱點,導致癌癥特異性細胞死亡。
