本期看點(diǎn)
1. 新型IL-15受體激動(dòng)劑NKTR-255聯(lián)用嵌合抗原受體(CAR)-T細(xì)胞療法治療復(fù)發(fā)或難治性B細(xì)胞急性淋巴細(xì)胞白血病(B-ALL),患者12個(gè)月時(shí)的無(wú)進(jìn)展生存率是單獨(dú)使用CAR-T細(xì)胞療法歷史對(duì)照組的兩倍(67%對(duì)比38%)。
2. 單抗療法briquilimab在針對(duì)慢性誘發(fā)性蕁麻疹(CIndU)患者開(kāi)展的1b/2a期研究中表現(xiàn)亮眼,93%的患者在接受治療后6周達(dá)成緩解。
3. 首個(gè)進(jìn)入人體臨床試驗(yàn)的工程化B細(xì)胞療法ISP-001的初步結(jié)果積極,首位接受治療的1型黏多糖貯積癥(MPS I)患者已停止使用標(biāo)準(zhǔn)療法。
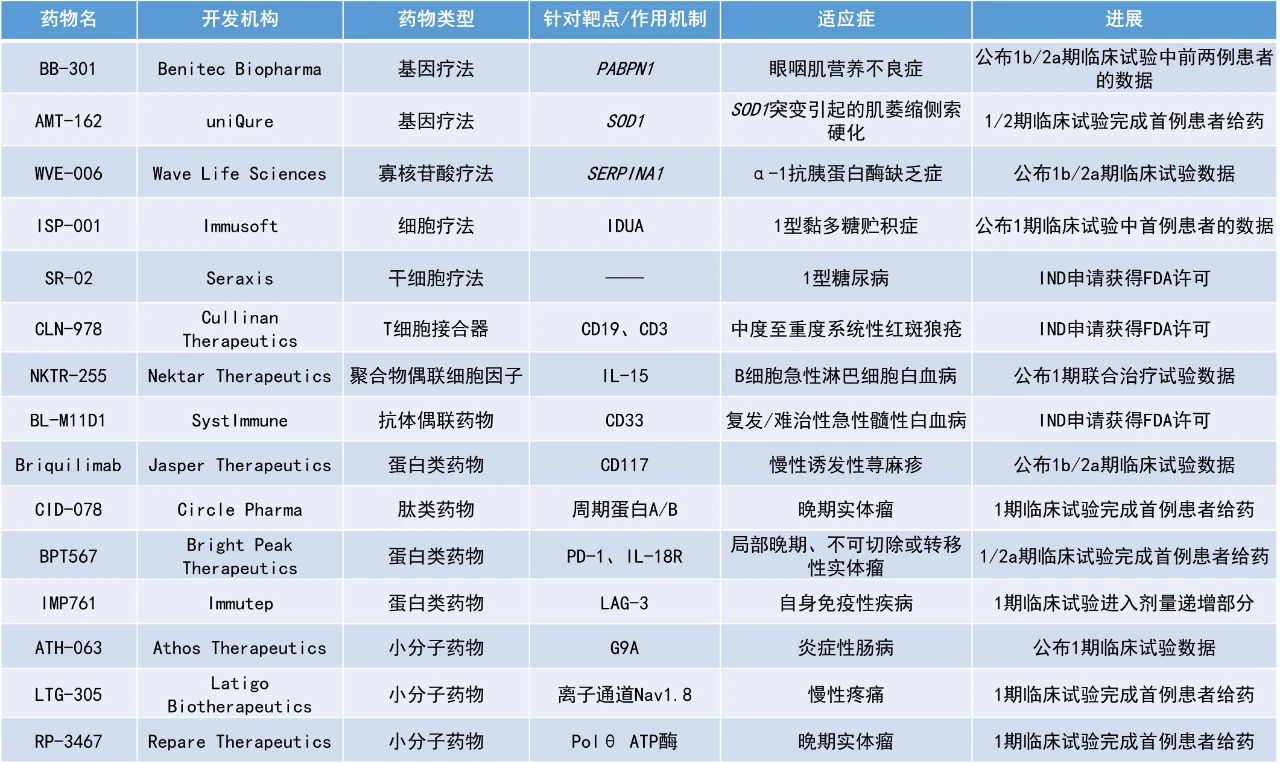
NKTR-255:公布1期聯(lián)合治療試驗(yàn)數(shù)據(jù)
Nektar Therapeutics公司公布了一項(xiàng)1期研究的首個(gè)臨床數(shù)據(jù),該研究評(píng)估了其新型IL-15受體激動(dòng)劑NKTR-255聯(lián)用靶向CD19和CD22的自體雙特異性CAR-T細(xì)胞療法治療復(fù)發(fā)或難治性B細(xì)胞急性淋巴細(xì)胞白血病患者的效果。NKTR-255是一種聚合物偶聯(lián)人IL-15,它能保持與IL-15受體α亞基的結(jié)合親和力,并降低清除率,從而提供持續(xù)的藥效學(xué)作用。NKTR-255具有增強(qiáng)免疫治療效果的潛力。
此次公布的結(jié)果顯示,NKTR-255聯(lián)用CAR-T細(xì)胞療法治療復(fù)發(fā)或難治性B-ALL患者的療效良好。9名患者中有8名獲得了完全緩解(CR),伴有或不伴有血液學(xué)恢復(fù),所有患者均未檢測(cè)到微小殘留病(MRD)。此外,與僅接受相同CAR-T細(xì)胞療法的歷史對(duì)照組相比,NKTR-255聯(lián)用CAR-T細(xì)胞療法組患者的12個(gè)月無(wú)復(fù)發(fā)生存率更高(67%對(duì)比38%)。歷史對(duì)照組患者的中位無(wú)復(fù)發(fā)生存期(RFS)為3.9個(gè)月,聯(lián)合治療組患者接受隨訪超過(guò)14個(gè)月,中位RFS尚未達(dá)到。安全性方面,未觀察到與NKTR-255相關(guān)的劑量限制性毒性。聯(lián)合治療組中觀察到的毒性與單獨(dú)使用CAR-T細(xì)胞治療后觀察到的毒性相似。
Briquilimab:公布1b/2a期臨床試驗(yàn)數(shù)據(jù)
Jasper Therapeutics公司公布了其候選單抗briquilimab用于治療慢性誘發(fā)性蕁麻疹的1b/2a期研究SPOTLIGHT的初步數(shù)據(jù)。Briquilimab是一種非糖基化單克隆抗體,可通過(guò)靶向細(xì)胞表面受體c-Kit(也稱(chēng)為CD117)以避免與干細(xì)胞因子結(jié)合,從而阻斷肥大細(xì)胞中的關(guān)鍵生存信號(hào),造成細(xì)胞凋亡與耗竭,從而消除肥大細(xì)胞驅(qū)動(dòng)疾病(如慢性蕁麻疹)中炎癥反應(yīng)的潛在來(lái)源。
此次公布的結(jié)果顯示,CIndU患者在接受briquilimab皮下注射后1周便觀察到CR,且93%的患者在接受治療后6周達(dá)成緩解。120毫克劑量組中,12名患者中有10名(83%)達(dá)到了CR,1名達(dá)成部分緩解(PR)。40毫克組中,1名患者達(dá)成CR,2名患者達(dá)成PR。該公司已獲得監(jiān)管批準(zhǔn)在SPOTLIGHT研究中招募患者接受更高劑量藥物的治療。
ISP-001:公布1期臨床試驗(yàn)中首例患者的數(shù)據(jù)
Immusoft公司公布了首位接受其工程化B細(xì)胞療法ISP-001治療的1型黏多糖貯積癥患者的積極結(jié)果。根據(jù)新聞稿,ISP-001是首個(gè)進(jìn)入人體臨床試驗(yàn)的工程化B細(xì)胞療法。該療法使用非病毒載體將表達(dá)α-L-艾杜糖苷酶的轉(zhuǎn)基因引入B細(xì)胞中,能夠讓經(jīng)過(guò)改造的B細(xì)胞長(zhǎng)期大量生產(chǎn)治療性蛋白,從而改善患者癥狀。
此次公布的臨床試驗(yàn)結(jié)果顯示,首位接受ISP-001治療的患者在接受治療3-8個(gè)月后,尿液中的多糖疾病生物標(biāo)志物水平降低到正常范圍內(nèi)。這名患者腦脊液中的硫酸乙酰肝素(HS)水平在接受治療6個(gè)月時(shí)降低25%。這是FDA認(rèn)可的一個(gè)與MPS I疾病活動(dòng)相關(guān)的替代終點(diǎn)。生物標(biāo)志物之外,這名患者的6分鐘行走檢測(cè)表現(xiàn)提高30%,并且肩部活動(dòng)范圍在6個(gè)月時(shí)得到改善。關(guān)節(jié)僵硬是MPS I的癥狀之一。在接受治療8個(gè)月后,該患者停止使用標(biāo)準(zhǔn)酶替代療法(ERT)。隨后的一個(gè)月里,患者的6分鐘行走檢測(cè)表現(xiàn)仍然獲得改善,不過(guò)幅度比6個(gè)月時(shí)有所下降,肩部活動(dòng)范圍的改善得到維持。安全性方面,ISP-001的耐受性良好。截至2024年9月19日,尚未報(bào)告任何不良事件。
WVE-006:公布1b/2a期臨床試驗(yàn)數(shù)據(jù)
Wave Life Sciences公司公布了其在研RNA編輯候選療法WVE-006用于治療α-1抗胰蛋白酶缺乏癥(AATD)的1b/2a期臨床試驗(yàn)RestorAATion-2的積極結(jié)果。AATD是一種可影響肺和肝臟功能的遺傳疾病,患者除了缺乏具有正常功能的α-1抗胰蛋白酶(AAT),其突變型AAT蛋白的積累也會(huì)損害肝臟和肺部。WVE-006是一款通過(guò)PN化學(xué)修飾和GalNAc偶聯(lián),以皮下注射方式給藥的潛在“first-in-class”RNA編輯寡核苷酸療法。WVE-006的設(shè)計(jì)旨在修復(fù)SERPINA1等位基因編碼mRNA中的單堿基突變,從而恢復(fù)血液中的功能性野生型AAT蛋白,同時(shí)減少異常AAT蛋白的存在,以潛在治療AATD相關(guān)的肺病和/或肝病。
此次公布的結(jié)果顯示,WVE-006能夠成功編輯AATD患者的基因。基線時(shí)未能檢測(cè)到患者體內(nèi)的AAT蛋白,而在試驗(yàn)第15天時(shí),患者的平均總AAT蛋白水平達(dá)到10.8微摩爾,達(dá)到了監(jiān)管機(jī)構(gòu)批準(zhǔn)AAT增強(qiáng)療法的標(biāo)準(zhǔn)。此外,早在試驗(yàn)第3天,患者的總AAT和M-AAT蛋白水平即較基線增加,并持續(xù)到第57天。根據(jù)新聞稿,WVE-006是首個(gè)進(jìn)入臨床開(kāi)發(fā)的RNA編輯療法,該試驗(yàn)結(jié)果是RNA編輯療法在人體當(dāng)中完成的首次機(jī)制驗(yàn)證。
BB-301:公布1b/2a期臨床試驗(yàn)中前兩例患者的數(shù)據(jù)
Benitec Biopharma公司公布了其開(kāi)發(fā)用于治療眼咽肌營(yíng)養(yǎng)不良(OPMD)的沉默和取代基因療法BB-301在早期臨床試驗(yàn)中的前兩例患者的積極數(shù)據(jù)。該療法利用一種新型的、經(jīng)過(guò)改良的AAV9載體,表達(dá)一種獨(dú)特的、單一的雙功能構(gòu)建體,從而能夠促進(jìn)密碼子優(yōu)化的PABPN1基因和兩個(gè)針對(duì)PABPN1突變體siRNA的共同表達(dá)。這兩個(gè)siRNA被塑造成微RNA骨架,以抑制有缺陷的PABPN1突變體的表達(dá),同時(shí)允許表達(dá)經(jīng)過(guò)密碼子優(yōu)化的PABPN1基因,用PABPN1蛋白的功能性版本取代突變體。
兩名患者接受了最低劑量的BB-301治療,未報(bào)告值得注意的不良事件。此次公布的結(jié)果顯示,1號(hào)患者和2號(hào)患者分別在接受BB-301治療9個(gè)月和6個(gè)月后,吞咽功能得到了持久且有臨床意義的改善。其中,在基線時(shí)癥狀更輕的2號(hào)患者的悉尼吞咽問(wèn)卷評(píng)分已達(dá)到了臨床定義的正常水平。新聞稿指出,這是使用新型基因療法成功改善OPMD患者吞咽功能的首次報(bào)道。
SR-02:IND申請(qǐng)獲得FDA許可
Seraxis公司宣布,其新型胰島替代療法SR-02的IND申請(qǐng)已獲得FDA許可,可開(kāi)展1/2期臨床研究。SR-02由同種異體胰腺內(nèi)分泌細(xì)胞簇組成,當(dāng)被植入網(wǎng)膜時(shí),可在患者自身的胰腺外形成功能性?xún)?nèi)分泌胰腺。SR-02能夠以臨床規(guī)模生產(chǎn),由健康供體胰腺組織進(jìn)行重編程后產(chǎn)生的專(zhuān)有干細(xì)胞系制成。新聞稿指出,SR-02作為一種有潛力功能性治愈需要胰島素的糖尿病患者的療法,是FDA許可的首個(gè)可用于人體試驗(yàn)的重編程干細(xì)胞衍生的候選胰腺產(chǎn)品。
CLN-978:IND申請(qǐng)獲得FDA許可
Cullinan Therapeutics公司宣布,美國(guó)FDA批準(zhǔn)了其新型、高效的CD19 x CD3靶向雙特異性T細(xì)胞接合器CLN-978的IND申請(qǐng),其針對(duì)中度至重度系統(tǒng)性紅斑狼瘡(SLE)患者的全球1期臨床試驗(yàn)可在美國(guó)開(kāi)展。新聞稿指出,CLN-978是首個(gè)在自身免疫疾病領(lǐng)域獲得美國(guó)FDA授予IND批準(zhǔn)的在研CD19靶向T細(xì)胞接合器。
CLN-978可在體外和體內(nèi)引發(fā)對(duì)表達(dá)CD19的靶細(xì)胞的定向裂解。CLN-978與CD19的結(jié)合親和力極高,可有效靶向B細(xì)胞,包括CD19水平極低的B細(xì)胞。CLN-978的分子量小(65 kDa),含有兩個(gè)單鏈可變片段,一個(gè)與CD19結(jié)合,另一個(gè)與T細(xì)胞上的CD3結(jié)合,還有一個(gè)與人血清白蛋白結(jié)合的單結(jié)構(gòu)域抗體,可延長(zhǎng)血清半衰期。CLN-978有望為SLE和類(lèi)風(fēng)濕性關(guān)節(jié)炎等自身免疫疾病患者提供一種方便、現(xiàn)貨型、皮下注射的治療選擇。
四川省醫(yī)藥保化品質(zhì)量管理協(xié)會(huì)組織召開(kāi)
2025版《中國(guó)藥典》將于2025年10月..關(guān)于舉辦四川省藥品生產(chǎn)企業(yè)擬新任質(zhì)量
各相關(guān)企業(yè): 新修訂的《中華人..四川省醫(yī)藥保化品質(zhì)量管理協(xié)會(huì)召開(kāi)第七
四川省醫(yī)藥保化品質(zhì)量管理協(xié)會(huì)第七..“兩新聯(lián)萬(wàn)家,黨建助振興”甘孜行活動(dòng)
為深入貫徹落實(shí)省委兩新工委、省市..學(xué)習(xí)傳達(dá)中央八項(xiàng)規(guī)定精神專(zhuān)題會(huì)議
2025年4月22日,協(xié)會(huì)黨支部組織召..關(guān)于收取2025年度會(huì)費(fèi)的通知
各會(huì)員單位: 在過(guò)去的一年里,..四川省應(yīng)對(duì)新型冠狀病毒肺炎疫情應(yīng)急指
四川省應(yīng)對(duì)新型冠狀病毒肺炎疫情應(yīng)..四川省應(yīng)對(duì)新型冠狀病毒肺炎疫情應(yīng)急指
四川省應(yīng)對(duì)新型冠狀病毒肺炎疫情應(yīng)..