10 月 15 日,CDE 官網(wǎng)顯示,恒瑞啟動一項(xiàng)諾利糖肽注射液(SHR20004)III 期臨床,主要研究目的是在二甲雙胍聯(lián)合或不聯(lián)合另一種口服降糖藥控制不佳的 2 型糖尿病(T2DM)患者中,證實(shí) SHR20004 控制血糖的有效性優(yōu)于安慰劑。
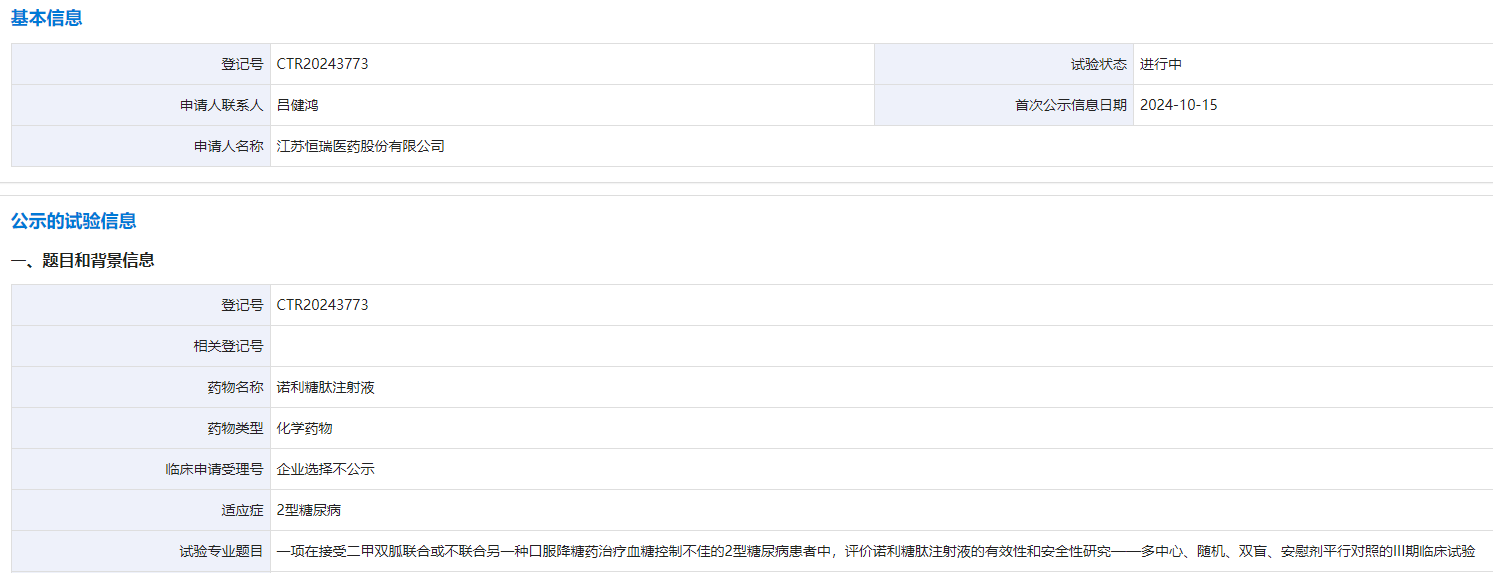
截圖來源:CDE 官網(wǎng)
諾利糖肽是一種 GLP-1 受體激動劑,給藥頻率為一天一次皮下注射,最早由恒瑞和豪森共同擁有,目前在研適應(yīng)癥主要為肥胖和 2 型糖尿病,其中,肥胖適應(yīng)癥目前正處于 II 期臨床。
2023 年 12 月,恒瑞公布了諾利糖肽在中國非糖尿病肥胖成年患者中的療效。
在一項(xiàng)為期 24 周的隨機(jī)、雙盲、安慰劑對照的 2 期臨床試驗(yàn)中(NCT04799327),254 名體重指數(shù)為 28.0-40.0 kg/m2 且無糖尿病的肥胖成年人被納入。受試者最以 1:1:1 的比例隨機(jī)分為三個劑量組: 0.12,0.24 或 0.36 mg 的研究治療。主要終點(diǎn)是體重從基線到第 24 周的變化。
結(jié)果顯示,在所有劑量組中,到第 24 周,最小二乘平均體重減少范圍 8.03-8.50 公斤,而安慰劑組為 3.65 公斤 (所有 p 值 < .0001)。
在三個劑量組中 (0.12,0.24,0.36 mg/天),與安慰劑組相比,體重減輕≥5% 比例分別為 68.8% ,60.0% ,73.0%;體重減輕≥10% 的分別為 37.5% ,36.9% ,39.7%;而安慰劑組體重減輕≥5% 為 29.0%,體重減輕≥10% 為 8.1%。
結(jié)果顯示與安慰劑相比,每日一次皮下注射諾伊格魯肽可顯著減少 24 周的體重,并且具有可控的安全性,主要不良反應(yīng)涉及胃腸道疾病(如惡心,腹瀉和嘔吐)。
國內(nèi)企業(yè) GLP-1 賽道
恒瑞管線數(shù)量位居第一
GLP-1 賽道在國內(nèi)已經(jīng)如火如荼,就布局該靶點(diǎn)新藥的企業(yè)來看,除了三家跨國藥企外,恒瑞在該靶點(diǎn)上布局的新藥管線數(shù)據(jù)已經(jīng)位居全球第四名了(與華東醫(yī)藥并列,非積極或者不活躍項(xiàng)目不統(tǒng)計(jì))。
具體來看,恒瑞的 7 款 GLP-1 靶點(diǎn)新藥中,有 4 款屬于重點(diǎn)推進(jìn)產(chǎn)品已經(jīng)進(jìn)展到 III 期臨床階段,分別為 HR17031(皮下注射)、HRS9531(皮下注射)、HRS-7535(口服)和諾利糖肽(皮下注射)。
HR17031 皮下注射,每日一次
HR17031 是恒瑞研發(fā)的一款是基礎(chǔ)胰島素類似物(INS068)和 GLP-1 受體激動劑(SHR20004)的固定復(fù)方制劑,每日給藥一次,在 2024 ADA 大會上,恒瑞公布了 HR17031 在 2 型糖尿病患者中的臨床結(jié)果。
這是一項(xiàng) II 期臨床研究,在接受口服降糖藥(OADs)治療仍血糖控制不佳的 2 型糖尿病患者中,評估 HR17031 相比兩單藥組分的有效性和安全性。
結(jié)果顯示,第 26 周時,與 INS068 組和 SHR20004 組的受試者相比,HR17031 組 HbA1c 較基線降低幅度更大(-2.4% vs-1.5%、-1.7%),表明 HR17031 降糖效果優(yōu)于 INS068 和 SHR20004。HR17031 組可使更多患者達(dá)到 HbA1c<7% 和<6.5% 的目標(biāo)(<7%,81.4%;<6.5%,74.3%),高于 INS068(47.8%;26.4%)和 SHR20004(55.6%;41.1%)。
與 INS068 相比,HR17031 可減輕體重(-0.1 kg vs 2.0 kg)。使用 HR17031 的胰島素日劑量低于 INS068(30.3 U/d vs 38.1 U/d)。
安全性方面,<3.0 mmol/L 的低血糖事件發(fā)生率為 HR17031(5.5%)和 INS068(4.4%)相似,未發(fā)生預(yù)期外的安全問題。
HRS9531 皮下注射,每周一次
HRS9531 是恒瑞研發(fā)的一種 GLP-1/GIP 雙受體激動劑,目前正在開展用于肥胖、2 型糖尿病、多囊卵巢綜合征、射血分?jǐn)?shù)保持的心力衰竭合并肥胖等適應(yīng)癥。
在 2024 ADA 大會上,恒瑞公布了 HRS9531 在肥胖患者中的臨床結(jié)果。這是一項(xiàng)隨機(jī)、雙盲、安慰劑對照的 II 期研究中,249 名 BMI 在 28-40 kg/m2 之間的中國成年人以 1:1:1:1:1 的比例被隨機(jī)分為 5 組,按所在組別依次對應(yīng)接受每周一次的 HRS9531 皮下注射(1.0 mg、3.0 mg、4.5 mg 和 6.0 mg)或安慰劑,持續(xù)治療 24 周。主要終點(diǎn)是第 24 周時體重較基線變化的百分比。
結(jié)果顯示,與基線相比,第 24 周時接受 HRS9531 皮下注射 1.0 mg、3.0 mg、4.5 mg 和 6.0 mg 組體重的最小二乘平均值(LS mean)百分比變化分別為-5.4%、-13.4%、-14.0% 和-16.8%,而安慰劑組為-0.1%。體重減輕≥5% 的受試者比例分別為 52.0%、88.2%、92.0%、91.8% 和 10.2%。
此外,HRS9531 在降低血壓、改善血糖控制和降低甘油三酯水平方面優(yōu)于安慰劑。HRS9531 組收縮壓從基線到第 24 周的 LS mean 變化范圍為-4.46 至-8.33 mmHg(安慰劑組:-0.41 mmHg),HRS9531 組腰圍變化范圍為-5.14 至-12.73 cm(安慰劑組:-1.82 cm)。
總體來看,HRS9531 可有效降低體重、血壓、血糖和甘油三酯,且具有良好的安全性。這些數(shù)據(jù)將支持 HRS9531 用于肥胖治療的進(jìn)一步臨床開發(fā)。
HRS-7535 口服,每日一次
是一種新型口服小分子 GLP-1R 激動劑,目前正在 2 型糖尿病和減重臨床研究。
2023 年 12 月,恒瑞公布了 HRS-7535 的 I 期臨床結(jié)果。
在劑量遞增部分的第 29 天,接受 HRS-7535 的參與者的體重從基線減少的平均值 (百分比) 為 4.38 kg (6.63%) ,而接受安慰劑的參與者為 0.8 kg (1.18%)。
HRS-7535 具有與其他 GLP-1RAs 一致的安全性和耐受性,并且表現(xiàn)出適合于每日一次給藥的 PKs。
4 款處于早期階段
除了上述進(jìn)展到 III 期臨床的 GLP-1 靶點(diǎn)新藥外,恒瑞還有 4 款新藥處于早期階段,包括 HRS9531 片(I 期臨床)、SHR-1816(I 期臨床)、SHR-2042(批準(zhǔn)臨床,不活躍)、HRS-4729(臨床前)。
其中 HRS9531 片是 HRS9531 的口服給藥形式,其用于 2 型糖尿病和肥胖適應(yīng)癥均進(jìn)入 1 期臨床階段;
SHR-1816 一款雙靶 GCGR 抗體/GLP-1 融合蛋白,其用于 2 型糖尿病已經(jīng)進(jìn)入 1 期臨床;
SHR-2042 也是一款口服 GLP-1 類似物,主要用于 2 型糖尿病及肥胖癥的治療。2018 年在國內(nèi)獲批臨床后,一直未檢測到有新的研發(fā)進(jìn)展。
HRS-4729 恒瑞研發(fā)的下一代腸促胰島素產(chǎn)品,可通過激活 GCGR/GIPR/GLP1R,保護(hù)胰島的同時提高胰島素分泌,控制血糖,目前尚處于臨床前開發(fā)階段。全球范圍內(nèi)尚無同類產(chǎn)品上市。
值得一提的是,恒瑞在今年 5 月達(dá)成的一項(xiàng)超 60 億美元的合作中,已經(jīng)將 GLP-1 產(chǎn)品組合(HRS-7535、HRS9531 與 HRS-4729)的大中華區(qū)以外的獨(dú)家權(quán)利有償許可給美國 Hercules 公司。
四川省醫(yī)藥保化品質(zhì)量管理協(xié)會組織召開
2025版《中國藥典》將于2025年10月..關(guān)于舉辦四川省藥品生產(chǎn)企業(yè)擬新任質(zhì)量
各相關(guān)企業(yè): 新修訂的《中華人..四川省醫(yī)藥保化品質(zhì)量管理協(xié)會召開第七
四川省醫(yī)藥保化品質(zhì)量管理協(xié)會第七..“兩新聯(lián)萬家,黨建助振興”甘孜行活動
為深入貫徹落實(shí)省委兩新工委、省市..學(xué)習(xí)傳達(dá)中央八項(xiàng)規(guī)定精神專題會議
2025年4月22日,協(xié)會黨支部組織召..關(guān)于收取2025年度會費(fèi)的通知
各會員單位: 在過去的一年里,..四川省應(yīng)對新型冠狀病毒肺炎疫情應(yīng)急指
四川省應(yīng)對新型冠狀病毒肺炎疫情應(yīng)..四川省應(yīng)對新型冠狀病毒肺炎疫情應(yīng)急指
四川省應(yīng)對新型冠狀病毒肺炎疫情應(yīng)..