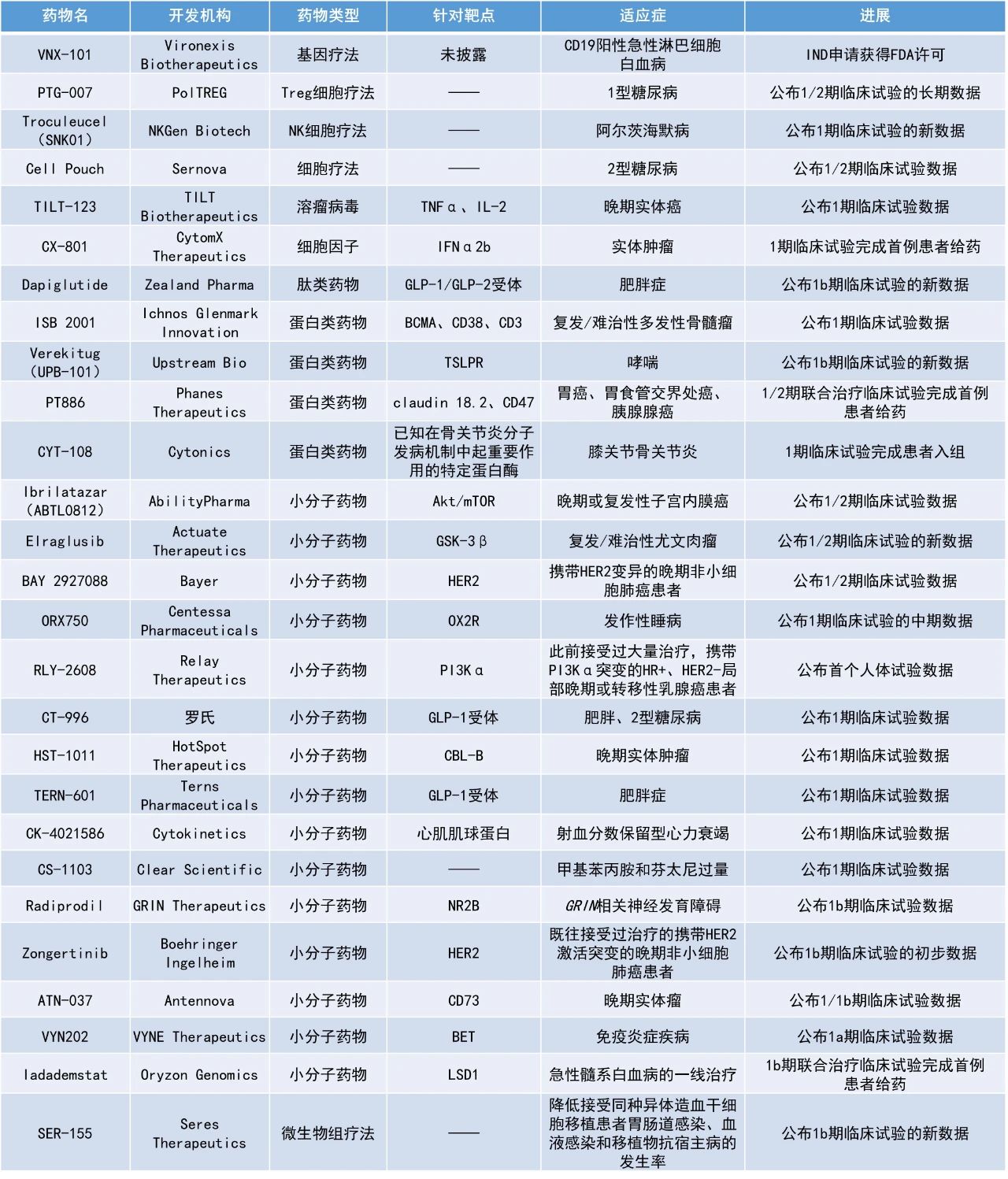
本期看點
Zongertinib:公布1b期臨床試驗的初步數據
勃林格殷格翰(Boehringer Ingelheim)公布了旗下口服HER2靶向療法zongertinib(BI 1810631)在NSCLC患者中的最新積極臨床結果。Zongertinib不與野生型表皮生長因子受體(EGFR)結合,進而相關毒性較低。Zongertinib于2023年獲得美國FDA授予快速通道資格,并隨后于2024年獲得美國FDA和中國國家藥監局藥品審評中心(CDE)授予的突破性療法認定,用于治療曾接受過全身性療法、攜帶HER2激活突變的晚期NSCLC成人患者。
此次公布的結果顯示,截至2024年5月,共132例患者每天接受一次120 mg/240 mg zongertinib治療(n=75/n=57)。經盲法獨立中央審評(BICR)評估,試驗達到主要終點,患者的確認ORR為66.7%(97.5% CI:53.8–77.5,p<0.0001)。在所有劑量的患者中,94%的患者觀察到任何程度的腫瘤縮小。
此外,數據還顯示,zongertinib具有初步的腦活性。根據BICR評估的RANO-BM(神經腫瘤腦轉移瘤的療效評估),33%(120 mg,n=27)和40%(240 mg,n=25)的無癥狀腦轉移患者達成確認的客觀緩解,疾病控制率(DCR)分別為74%和92%。Zongertinib在120 mg和240 mg劑量下的耐受性通常良好,沒有因治療導致的死亡,且導致劑量減少(11%)和停藥(3%)的不良事件發生率低。
BAY 2927088:公布1/2期臨床試驗數據
拜耳(Bayer)公布了1/2期SOHO-01研究擴展部分的積極結果。該研究評估了其口服、可逆的HER2靶向療法BAY 2927088在攜帶HER2變異的晚期NSCLC患者中的安全性和初步療效。入組患者在接受≥1種晚期疾病全身治療后病情出現進展,但未曾接受過HER2靶向治療。BAY 2927088能夠強效抑制突變的HER2,包括HER2外顯子20插入突變和HER2點突變,同時也能抑制EGFR,對突變型EGFR具有高選擇性,且不和野生型EGFR相結合。美國FDA和中國藥品審評中心于2024年授予BAY 2927088突破性療法認定,用于治療攜帶HER2激活突變且曾接受過全身治療的不可切除或轉移性NSCLC成年患者。
此次公布的結果顯示,43名可評估療效患者的確認ORR為72.1%,1名(2.3%)患者實現完全緩解(CR)。中位緩解持續時間(DOR)和PFS分別為8.7個月和7.5個月。在攜帶HER2 YVMA插入突變(最常見的變異)的患者中,ORR為90.0%,DOR為9.7個月,PFS為9.9個月。此外,BAY 2927088的安全性是可控的,并且與之前的報告一致。
Ibrilatazar(ABTL0812):公布1/2期臨床試驗數據
AbilityPharma公司公布了ibrilatazar聯用化療(紫杉醇/卡鉑)治療晚期或復發性子宮內膜癌患者的1/2期臨床試驗ENDOLUNG的最終數據。Ibrilatazar是一種潛在“first-in-class”、差異化的口服靶向抗癌化合物,通過誘導內質網應激和抑制PI3K/Akt/mTOR通路來引發自噬。在臨床試驗中,ibrilatazar對子宮內膜癌和肺癌患者顯示出臨床益處。此外,它在包括肺癌、子宮內膜癌、胰腺癌、神經母細胞瘤和膠質母細胞瘤等癌癥類型的動物模型中展示了強有力的臨床前概念驗證。
此次公布的結果顯示,ibrilatazar聯用化療的總緩解率為65.8%,其中13.2%的患者達到CR,52.6%的患者達到部分緩解(PR),中位DOR為7.4個月。中位PFS為9.8個月,相比歷史對照組延長了40%。中位總生存期(OS)為23.6個月。這些結果表明,接受ibrilatazar聯用化療治療的患者的ORR、PFS和OS相較于歷史對照組(分別為51%、7.1個月和20.4個月)均有所提高。
安全性方面,ibrilatazar聯用化療治療顯示出良好的安全性,未引入與化療相關的重大不良事件,其安全性與歷史對照組一致。藥代動力學參數與臨床前試驗中觀察到的靶點作用相符,血液藥效學生物標志物表明治療開始后至少28天內靶點調節持續存在。
RLY-2608:公布首個人體試驗數據
Relay Therapeutics公司公布了其在研療法RLY-2608的首個人體試驗的積極中期數據。RLY-2608是Relay Therapeutics開發針對PI3Kα突變體的選擇性抑制劑。該激酶是所有癌癥中最常出現突變的激酶之一,約在14%的實體瘤患者檢測出PI3Kα的致癌突變。傳統上,PI3Kα抑制劑的開發聚焦于蛋白的活性位點。然而,這些抑制劑缺乏對突變型PI3Kα的選擇性,導致治療效果欠佳。為了增強PI3Kα抑制劑的選擇性,Relay Therapeutics解析了PI3Kα的全長蛋白冷凍電鏡結構,以闡明野生型和突變型PI3Kα的構象差異,并利用這些見解支持RLY-2608的設計。
此次公布的數據顯示,此前接受過大量治療,攜帶PI3Kα突變的HR陽性、HER2陰性局部晚期或轉移性乳腺癌患者在接受RLY-2608(600 mg)聯合fulvestrant治療后,表現出具有臨床意義的PFS。中位隨訪時間為7.5個月時,所有攜帶PI3Kα突變患者的中位PFS為9.2個月。在30名具有可測量疾病的患者中,1/3的患者達到PR,ORR為33%。新聞稿指出,RLY-2608是首個針對PI3Kα,具有突變體和異構體(isoform)選擇性的別構抑制劑。
Mosliciguat:公布1b期臨床試驗數據
Roivant公司公布了其肺動脈高壓(PH)療法mosliciguat的1b期概念驗證試驗的結果。Mosliciguat是一種每日給藥一次、潛在"first-in-class"和“best-in-class”的吸入性可溶性鳥苷酸環化酶(sGC)激動劑,可靶向遞送至肺部。sGC是一種一氧化氮(NO)/環磷酸鳥苷(cGMP)信號通路中的關鍵酶,可催化cGMP生成,從而增加血管擴張、減少炎癥和細胞凋亡、逆轉血管重塑和抗纖維化作用。與需要減少血紅素和NO才能對sGC產生作用的sGC激動劑不同,mosliciguat是一種獨立于血紅素和NO的sGC激活劑。這使mosliciguat可能在典型PH患者體內高氧化環境中保持有效性。該療法目前正在開發用于治療與間質性肺病(PH-ILD)相關的肺動脈高壓。
四川省醫藥保化品質量管理協會組織召開
2025版《中國藥典》將于2025年10月..關于舉辦四川省藥品生產企業擬新任質量
各相關企業: 新修訂的《中華人..四川省醫藥保化品質量管理協會召開第七
四川省醫藥保化品質量管理協會第七..“兩新聯萬家,黨建助振興”甘孜行活動
為深入貫徹落實省委兩新工委、省市..學習傳達中央八項規定精神專題會議
2025年4月22日,協會黨支部組織召..關于收取2025年度會費的通知
各會員單位: 在過去的一年里,..四川省應對新型冠狀病毒肺炎疫情應急指
四川省應對新型冠狀病毒肺炎疫情應..四川省應對新型冠狀病毒肺炎疫情應急指
四川省應對新型冠狀病毒肺炎疫情應..