本期看點
2. 治療杜氏肌營養(yǎng)不良(DMD)的抗體偶聯(lián)寡核苷酸療法delpacibart zotadirsen(del-zota)早期臨床數(shù)據(jù)積極,它顯著提高了患者抗肌萎縮蛋白的生產(chǎn),最高達(dá)到了正常水平的54%。
3. 治療微衛(wèi)星穩(wěn)定(MSS)轉(zhuǎn)移性結(jié)直腸癌(mCRC)的腫瘤浸潤淋巴細(xì)胞(TIL)療法TIDAL-01在一項1期臨床試驗中的疾病控制率(DCR)達(dá)50%,1名患者獲得CR。
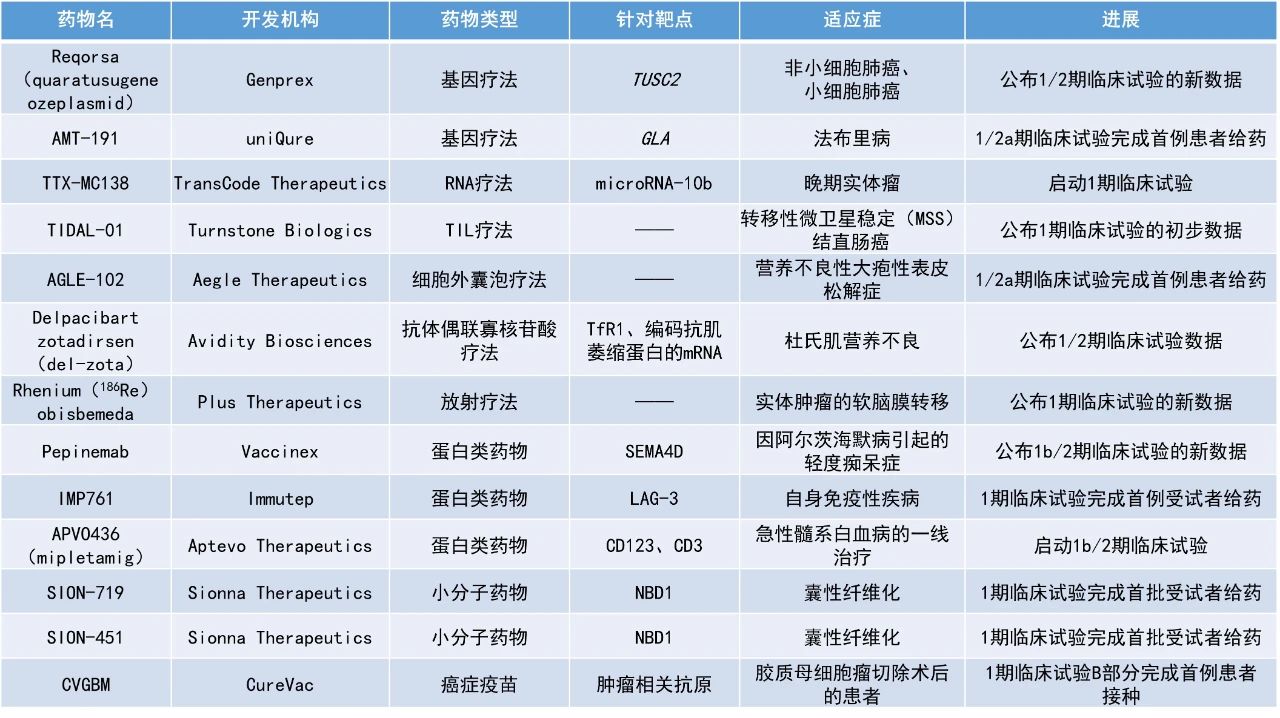
APVO436(mipletamig):啟動1b/2期臨床試驗
Aptevo Therapeutics公司宣布啟動一項1b/2期劑量優(yōu)化試驗RAINIER,這是其正在進行的一個旨在評估APVO436與維奈托克和阿扎胞苷聯(lián)用一線治療急性髓性白血病患者項目的一部分。APVO436是一種創(chuàng)新雙特異性重組蛋白,它像兩個單克隆抗體連接在一起,可以同時靶向腫瘤細(xì)胞表面的CD123和T淋巴細(xì)胞表面的CD3,從而將宿主免疫系統(tǒng)的T細(xì)胞重定向到患者的腫瘤細(xì)胞上,以快速和完全摧毀表面表達(dá)CD123的腫瘤細(xì)胞。APVO436經(jīng)改造后可在血液循環(huán)中停留足夠長的時間,以發(fā)現(xiàn)、結(jié)合并破壞白血病細(xì)胞。
此前,該公司已經(jīng)在兩項試驗中分別評估了APVO436單藥或與維奈托克和阿扎胞苷聯(lián)用治療AML患者的效果。APVO436單藥使2例患者獲得了CR,且大多數(shù)細(xì)胞因子釋放綜合征(CRS)病例是低級別且臨床可控的。在未接受過維奈托克治療的患者中,APVO436與維奈托克和阿扎胞苷聯(lián)用的臨床獲益率為91%,在將該聯(lián)合療法作為一線治療的患者中有75%獲得了CR。接受聯(lián)合療法的患者中只有27%出現(xiàn)CRS,且大多數(shù)病例是低級別且臨床可控的。
Delpacibart zotadirsen(del-zota):公布1/2期臨床試驗數(shù)據(jù)
Avidity Biosciences公司宣布,其在研抗體偶聯(lián)寡核苷酸療法delpacibart zotadirsen(del-zota)在適合接受外顯子44跳躍療法治療的杜氏肌營養(yǎng)不良(DMD44)患者中進行的1/2期臨床試驗EXPLORE44中獲得積極數(shù)據(jù)。DMD是由于編碼抗肌萎縮蛋白的基因產(chǎn)生突變,導(dǎo)致抗肌萎縮蛋白缺失或功能失常,造成患者肌肉功能的終身、漸進性喪失。Del-zota由靶向1型轉(zhuǎn)鐵蛋白受體(TfR1)的單克隆抗體和促進編碼抗肌萎縮蛋白的mRNA前體產(chǎn)生外顯子44跳躍的寡核苷酸偶聯(lián)而成。這款療法通過改變mRNA剪接過程,產(chǎn)生幾乎與正常抗肌萎縮蛋白功能相同的蛋白。靶向TfR1的單克隆抗體可以通過與肌肉細(xì)胞表面的受體相結(jié)合,增強寡核苷酸的肌肉特異性遞送。
此次公布的結(jié)果顯示,del-zota顯著提高了患者抗肌萎縮蛋白的生產(chǎn),最高達(dá)到了正常水平的54%。此外,del-zota使肌酸激酶水平下降至接近正常水平,與基線相比減少超過80%。Del-zota還展現(xiàn)了良好的安全性和耐受性,大多數(shù)治療出現(xiàn)的不良事件在DMD44患者中為輕度或中度。Avidity公司表示,將與美國FDA展開討論,尋求加速批準(zhǔn)這一療法的最佳途徑。
TIDAL-01:公布1期臨床試驗的初步數(shù)據(jù)
Turnstone Biologics公司公布了其候選TIL療法TIDAL-01治療MSS-mCRC患者的1期臨床試驗的初步數(shù)據(jù)。TIDAL-01是利用無偏倚的識別和功能篩選過程,從患者的腫瘤中分離并選擇性地擴增最全面的腫瘤反應(yīng)性TIL制得的。為了更有效地殺傷腫瘤,TIDAL-01的生產(chǎn)過程旨在提供具有顯著更高比例的功能性和強效的腫瘤反應(yīng)性T細(xì)胞,其設(shè)計目標(biāo)是至少提供10?個細(xì)胞。
截至2024年7月15日的數(shù)據(jù),在接受TIDAL-01治療的前4名可評估晚期CRC患者中觀察到的總緩解率為25%,DCR為50%,一名患者表現(xiàn)出深度而持久的持續(xù)CR。50%的患者表現(xiàn)出持續(xù)的臨床益處,持續(xù)CR患者的無進展生存期(PFS)超過1年,疾病穩(wěn)定患者的PFS為6個月。安全性方面,TIDAL-01通常耐受性良好,觀察到的安全性事件與淋巴細(xì)胞耗竭方案以及IL-2和pembrolizumab給藥相關(guān)的已知不良事件一致。
Reqorsa(quaratusugene ozeplasmid):公布1/2期臨床試驗的新數(shù)據(jù)
Genprex公司宣布,其候選基因療法Reqorsa(quaratusugene ozeplasmid)治療非小細(xì)胞肺癌(NSCLC)和小細(xì)胞肺癌(SCLC)的Acclaim-1和Acclaim-3臨床試驗取得了新的積極結(jié)果。Reqorsa是一種利用脂基納米顆粒遞送表達(dá)抑癌基因TUSC2的質(zhì)粒的基因療法。Reqorsa經(jīng)靜脈注射,能被癌細(xì)胞吸收,并在癌細(xì)胞中重新表達(dá)抑癌基因。
Rhenium(186Re)obisbemeda:公布1期臨床試驗的新數(shù)據(jù)
Plus Therapeutics公司公布了其主打放射治療藥物Rhenium(186Re)obisbemeda治療軟腦膜疾病(LM)的臨床試驗ReSPECT-LM的最新數(shù)據(jù)。186Re obisbemeda是一款新型可注射放療藥物,專門配制用于以安全、有效和方便的方式在中樞神經(jīng)系統(tǒng)腫瘤中遞送專一靶向的高劑量輻射,以優(yōu)化患者臨床結(jié)局。由于186Re的半衰期短,具有破壞癌組織的β放射能和可用于活體成像的γ放射能,是中樞神經(jīng)系統(tǒng)治療應(yīng)用的理想放射性同位素。
16名患者接受了治療,包括8名原發(fā)癌癥為乳腺癌的患者,4名原發(fā)癌癥為肺癌的患者,以及4名原發(fā)癌癥為其他癌癥的患者。此次公布的結(jié)果顯示,治療后28天時,隊列1-3組患者的腦脊液循環(huán)腫瘤細(xì)胞(CTC)與基線相比平均減少了53%(CTC僅在隊列1-3中進行了檢測)。隊列1-4組患者的中位總生存期為12個月,16名患者中有8人在分析時仍存活。所有4個隊列中的大多數(shù)不良事件為輕度或中度,與研究藥物無關(guān)或不太可能相關(guān)。
TTX-MC138:啟動1期臨床試驗
TransCode Therapeutics公司宣布啟動其主要候選治療藥物TTX-MC138的1期多中心、開放標(biāo)簽臨床研究,旨在評估TTX-MC138在各種轉(zhuǎn)移性實體癌患者中的安全性。TTX-MC138旨在抑制促轉(zhuǎn)移RNA——microRNA-10b,它被認(rèn)為是多種晚期實體瘤轉(zhuǎn)移的主要調(diào)節(jié)因子。
在臨床前研究中,TTX-MC138展現(xiàn)出對多種癌癥模型的有效性,包括乳腺癌、胰腺癌、卵巢癌、結(jié)腸癌、膠質(zhì)母細(xì)胞瘤等等。此前公布的0期臨床試驗結(jié)果顯示,TTX-MC138能顯著抑制患者血液中的miRNA-10b,miRNA-10b在給藥后的24小時內(nèi)減少了66%。此外,TTX-MC138的耐受性良好,未發(fā)現(xiàn)任何不良反應(yīng)。
四川省醫(yī)藥保化品質(zhì)量管理協(xié)會組織召開
2025版《中國藥典》將于2025年10月..關(guān)于舉辦四川省藥品生產(chǎn)企業(yè)擬新任質(zhì)量
各相關(guān)企業(yè): 新修訂的《中華人..四川省醫(yī)藥保化品質(zhì)量管理協(xié)會召開第七
四川省醫(yī)藥保化品質(zhì)量管理協(xié)會第七..“兩新聯(lián)萬家,黨建助振興”甘孜行活動
為深入貫徹落實省委兩新工委、省市..學(xué)習(xí)傳達(dá)中央八項規(guī)定精神專題會議
2025年4月22日,協(xié)會黨支部組織召..關(guān)于收取2025年度會費的通知
各會員單位: 在過去的一年里,..四川省應(yīng)對新型冠狀病毒肺炎疫情應(yīng)急指
四川省應(yīng)對新型冠狀病毒肺炎疫情應(yīng)..四川省應(yīng)對新型冠狀病毒肺炎疫情應(yīng)急指
四川省應(yīng)對新型冠狀病毒肺炎疫情應(yīng)..