本期看點
1. 治療天使綜合征(Angelman syndrome,AS)的在研反義寡核苷酸(ASO)療法ION582在一項早期臨床試驗中使高達97%接受中、高劑量患者的整體AS癥狀獲得緩解。
2. 希望之城(City of Hope)開發(fā)的用于治療轉移性去勢抵抗性前列腺癌(mCRPC)的嵌合抗原受體(CAR)T細胞療法在1期臨床試驗中使1例患者的前列腺特異性抗原(PSA)水平下降>90%。
3. 多款治療阿爾茨海默病的創(chuàng)新療法獲積極早期結果。
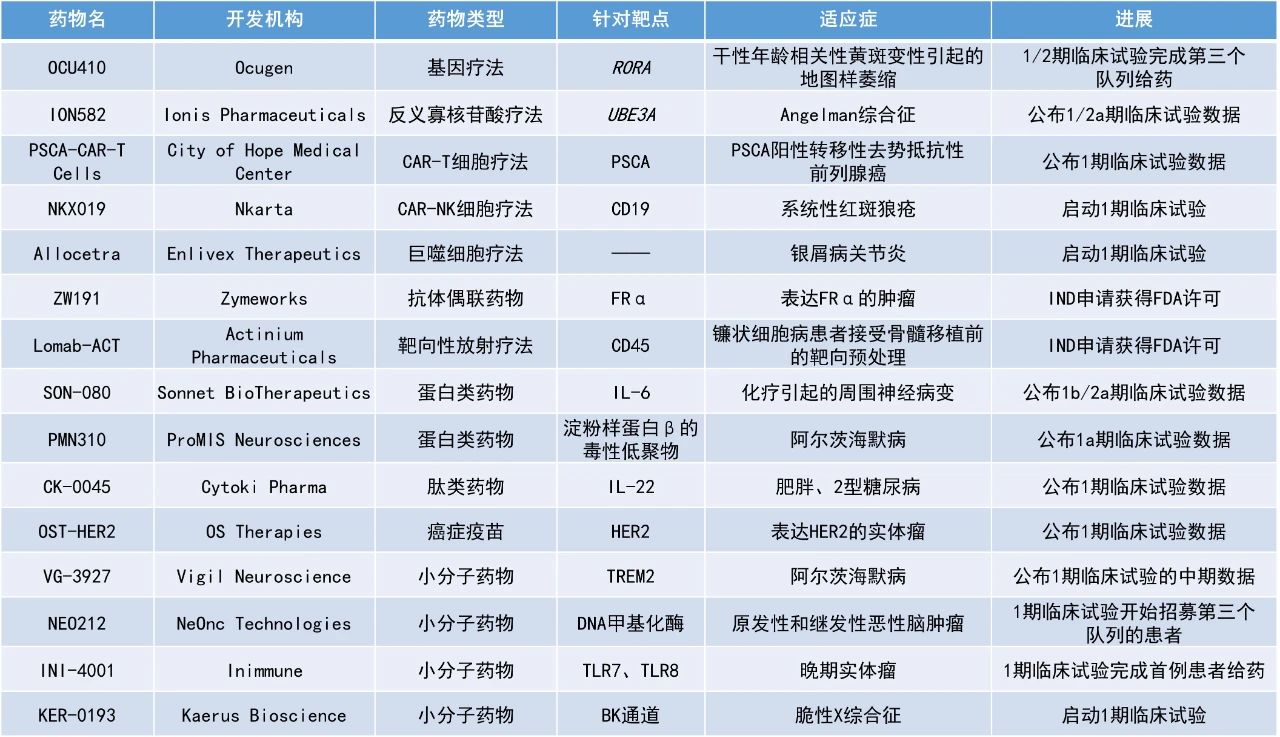
ION582:布1/2a期臨床試驗數(shù)據(jù)
Ionis Pharmaceuticals公司宣布,其在研ASO療法ION582治療天使綜合征的1/2a期研究HALOS已完成多次劑量遞增(MAD)部分,并取得積極成果。ION582是一款通過脊椎穿刺鞘內給藥的在研ASO療法,旨在抑制UBE3A反義轉錄本(UBE3A-ATS)的表達,并激活來自父體的UBE3A等位基因以增加患者大腦中UBE3A蛋白的產生,為天使綜合征的潛在療法。臨床前研究顯示,ION582能夠顯著增加動物的學習和記憶功能,以及其大腦中UBE3A蛋白的表達。美國FDA在2022年授予ION582孤兒藥資格和罕見兒科疾病資格。
此次公布的結果顯示,ION582持續(xù)改善了患者的溝通、認知和運動功能,高達97%接受中、高劑量患者的整體AS癥狀獲得緩解。根據(jù)此積極結果,Ionis計劃與監(jiān)管單位進行討論,并于2025年上半年啟動關鍵3期研究。
PSCA-CAR-T Cells:公布1期臨床試驗數(shù)據(jù)
《自然-醫(yī)學》(Nature Medicine)雜志發(fā)表了一項由希望之城開展的單中心1期臨床試驗的積極結果。該研究旨在評估前列腺干細胞抗原(PSCA)靶向CAR-T細胞療法治療轉移性去勢抵抗性前列腺癌的效果。該細胞療法是在希望之城的GMP工廠制造的,只提供給參加試驗的患者。
此次公布的結果顯示,該CAR-T細胞擴增和持續(xù)至輸注后28天,3個劑量隊列分別有1例、3例和3例患者的PSA水平下降,14例患者中有4例患者的PSA降幅>30%。其中,隊列2中有1例患者在輸注CAR-T細胞后的首個28天內,PSA降幅>90%。三個隊列的疾病控制率分別為0%、67%和60%,6個月生存率分別為33%、67%和40%。該臨床研究結果表明PSCA-CAR-T細胞療法治療mCRPC是安全的,有望成為mCRPC患者治療新選擇。
PMN310:公布1a期臨床試驗數(shù)據(jù)
ProMIS Neurosciences公司宣布,其用于治療阿爾茨海默病的新型單克隆抗體PMN310在健康受試者中進行的1a期臨床試驗的前四個隊列均獲得了積極結果。PMN310能夠高選擇性地靶向被認為是阿爾茨海默病主要驅動因素的β淀粉樣蛋白(Aβ)寡聚體。在臨床前研究中,PMN310與其他靶向Aβ的抗體相比,對Aβ寡聚體表現(xiàn)出更強大的體外靶向作用。此外,PMN310未觀察到與斑塊的結合,可能會降低使用斑塊結合抗體引起的淀粉樣蛋白相關成像異常(ARIA)的風險。這些數(shù)據(jù)支持該療法具有潛在的差異化臨床特征。
該初步研究的結果表明,在健康受試者中,四種遞增劑量水平的PMN310的安全性和耐受性良好,患者腦脊液中的PMN310抗體水平與劑量有關,這表明該抗體有可能成為阿爾茨海默病患者的靶向藥物。
VG-3927:公布1期臨床試驗的中期數(shù)據(jù)
Vigil Neuroscience公司公布了其阿爾茨海默病療法VG-3927在健康受試者中進行的1期臨床試驗的中期數(shù)據(jù)。VG-3927是一種新型小分子TREM2激動劑,用于治療與小膠質細胞功能障礙相關的常見神經(jīng)退行性疾病,最初主要針對阿爾茨海默病患者,包括一些攜帶TREM2和其他疾病相關突變體的患者。
此次公布的結果顯示,VG-3927的安全性、耐受性、藥代動力學和藥效學特征支持將其作為治療阿爾茨海默病的潛在每日一次口服療法繼續(xù)進行開發(fā)。此外,VG-3927能顯著降低患者腦脊液中的可溶性TREM2,證明其具有臨床靶向性。VG-3927重復給藥后,骨橋蛋白/分泌磷蛋白1(SPP1)增加,這是一種與神經(jīng)保護性小膠質細胞相關的生物標志物。該公司計劃在2025年第一季度報告完整的1期臨床數(shù)據(jù)。
NEO212:1期臨床試驗開始招募第三個隊列的患者
NeOnc Technologies公司宣布,其用于治療原發(fā)性和繼發(fā)性惡性腦腫瘤的新型混合藥物NEO212的1期臨床試驗已開始招募第三個隊列的患者。NEO212是該公司的主要候選藥物NEO100和替莫唑胺(TMZ)的生物偶聯(lián)物。相比于將NEO100和TMZ簡單混合,共價鍵合的NEO212有望提供更有效的腦癌治療。臨床前動物研究表明,與TMZ相比,NEO212的毒性可能較小,有望以三倍的效率穿透血腦屏障,并發(fā)揮十倍的效力。
OST-HER2:公布1期臨床試驗數(shù)據(jù)
OS Therapies公司宣布,其生物治療候選藥物OST-HER2在HER2表達實體瘤(乳腺癌和其他癌癥)患者中的1期臨床試驗數(shù)據(jù)良好。OST-HER2是一種以單核細胞增生李斯特氏菌(Listeria monocytogenes,Lm)為載體的現(xiàn)貨型免疫治療疫苗,旨在預防骨肉瘤和其他實體瘤患者的轉移、延緩復發(fā)并提高總生存率。
OST-HER2的作用機制是通過激活抗原呈遞細胞生成靶向HER2的特異性T細胞,這些T細胞增殖后定位、滲透并直接攻擊腫瘤病灶,殺死腫瘤細胞并暴露出更多抗原。隨后,免疫系統(tǒng)會根據(jù)新抗原生成更多的T細胞。該機制通過循環(huán)產生和激活T細胞,以持續(xù)延長抗腫瘤效果。此次公布的數(shù)據(jù)顯示,OST-HER2在表達HER2的實體瘤患者中是安全的,并且耐受性良好。
Lomab-ACT:IND申請獲得FDA許可
Actinium Pharmaceuticals公司宣布,F(xiàn)DA批準了其用于鐮狀細胞病患者在骨髓移植(BMT)前進行靶向調理的候選療法Iomab-ACT的IND申請。這項試驗旨在評估Iomab-ACT在接受同種異體BMT的鐮狀細胞病患者中的安全性。Lomab-ACT是一種靶向CD45的抗體偶聯(lián)放射物(ARC),旨在取代目前在細胞和基因療法之前用于調理患者的非靶向化療和全身放射治療,從而使鐮狀細胞病患者能夠更廣泛地獲得有望治愈疾病的同種異體BMT或基因治療。
四川省醫(yī)藥保化品質量管理協(xié)會組織召開
2025版《中國藥典》將于2025年10月..關于舉辦四川省藥品生產企業(yè)擬新任質量
各相關企業(yè): 新修訂的《中華人..四川省醫(yī)藥保化品質量管理協(xié)會召開第七
四川省醫(yī)藥保化品質量管理協(xié)會第七..“兩新聯(lián)萬家,黨建助振興”甘孜行活動
為深入貫徹落實省委兩新工委、省市..學習傳達中央八項規(guī)定精神專題會議
2025年4月22日,協(xié)會黨支部組織召..關于收取2025年度會費的通知
各會員單位: 在過去的一年里,..四川省應對新型冠狀病毒肺炎疫情應急指
四川省應對新型冠狀病毒肺炎疫情應..四川省應對新型冠狀病毒肺炎疫情應急指
四川省應對新型冠狀病毒肺炎疫情應..