2024年優先審評,17款抗癌新藥被納入,來自輝瑞、默沙東、正大天晴、恒瑞等!
發布時間: 2024-07-16 來源: 藥明康德
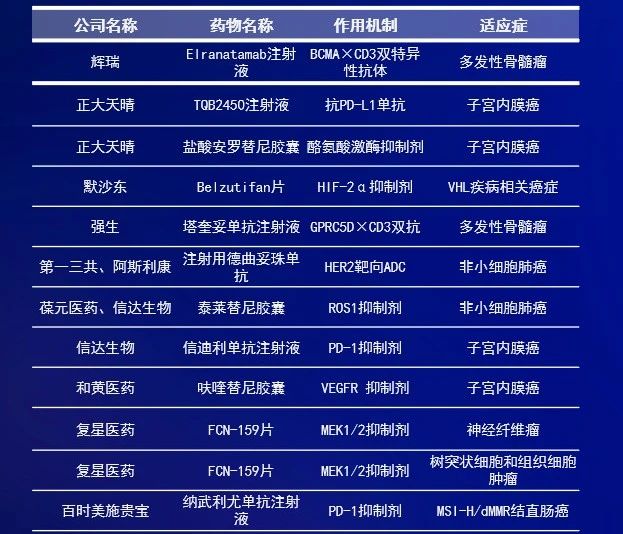
優先審評是中國國家藥品監督管理局藥品審評中心(CDE)推出的加速藥物獲批上市的重要政策之一。根據CDE發布的《2023年度藥品審評報告》,獲得優先審評審批的藥物上市注冊申請的審評時限由常規程序的200日縮短為130日,獲批速度顯著提升。根據CDE官網公示信息,截至6月27日,2024年上半年共計有26個創新藥的上市申請正式被納入優先審評。從治療領域來看,抗腫瘤藥物最多,有17個,占比超65%。本文中就讓我們來看看這些抗腫瘤藥物都有哪些?它們都有望惠及哪些癌癥患者?數據來源:CDE官網,《醫藥觀瀾》梳理。本表僅統計正式被納入優先審評的藥物,不含擬納入藥品。統計截至日期:2024年6月27日2024年1月,輝瑞(Pfizer)公司的elranatamab注射液上市申請被CDE納入優先審評,用于治療既往接受過至少三種治療的復發或難治性多發性骨髓瘤(MM)成人患者。Elranatamab是一款皮下注射BCMA×CD3雙特異性抗體,其一端與骨髓瘤細胞上的BCMA相結合,另一端與T細胞表面的CD3受體結合,使它們結合在一起并激活T細胞殺死骨髓瘤細胞。該藥已于2023年獲FDA加速批準,用于治療復發/難治性MM患者。2024年1月,正大天晴申報的TQB2450注射液和安羅替尼膠囊聯合療法的一項上市申請被CDE納入優先審評,擬用于治療既往接受過一、二線化療方案治療失敗或不能耐受的非微衛星高度不穩定(非MSI-H)或非DNA錯配修復缺陷(非dMMR)的復發性或轉移性子宮內膜癌患者。貝莫蘇拜單抗(TQB2450)是一款抗PD-L1人源化單克隆抗體,已于今年5月獲批聯合安羅替尼膠囊和依托泊苷及卡鉑一線治療廣泛期小細胞肺癌。安羅替尼是一種新型小分子多靶點酪氨酸激酶抑制劑,此前已在中國獲批用于治療多種腫瘤適應癥。2024年2月,默沙東(MSD)的belzutifan片上市申請被CDE納入優先審評,擬用于治療von Hippel-Lindau(VHL)病相關腎細胞癌、中樞神經系統血管母細胞瘤或胰腺神經內分泌腫瘤。VHL是一種罕見遺傳疾病,它可異常激活癌癥患者體內的缺氧誘導因子(HIF-2α)。Belzutifan是一款選擇性新型口服HIF-2α抑制劑,此前已獲FDA批準用于治療VHL疾病相關癌癥。2024年2月,強生(Johnson & Johnson)公司申報的塔奎妥單抗注射液被CDE納入優先審評,單藥治療既往接受過至少三種治療的復發或難治性多發性骨髓瘤成人患者。公開資料顯示,塔奎妥單抗(talquetamab)是一款皮下注射雙特異性抗體,靶向GPRC5D和CD3,已于2023年8月獲美國FDA加速批準上市,用于治療復發性或難治性多發性骨髓瘤成人患者。2024年2月,第一三共(Daiichi Sankyo)公司申報的注射用德曲妥珠單抗被CDE正式納入優先審評,擬定適應癥為:存在HER2(ERBB2)激活突變且既往接受過至少一種系統治療的不可切除或轉移性成人NSCLC患者。德曲妥珠單抗是阿斯利康(AstraZeneca)和第一三共聯合開發的一款靶向HER2的抗體偶聯藥物(ADC),此前已在中國獲批治療HER2陽性和HER2低表達成人乳腺癌患者。2024年2月,葆元醫藥(現已被Nuvation Bio收購)申報的泰萊替尼膠囊上市申請被CDE納入優先審評,用于未經ROS1-TKI治療的ROS1陽性局部晚期或轉移性NSCLC成人患者的治療。泰萊替尼是新一代口服選擇性ROS1抑制劑,具有腦滲透潛力。2021年6月,葆元與信達生物簽訂了獨家許可協議,在大中華區(包括中國大陸、香港、澳門和臺灣地區)共同開發和商業化泰萊替尼。2024年3月,信達生物的PD-1抑制劑信迪利單抗與和黃醫藥的VEGFR抑制劑呋喹替尼的聯合療法上市申請被CDE納入優先審評,擬用于既往系統性抗腫瘤治療后疾病進展且不適合進行根治性手術治療或根治性放療的晚期pMMR或non MSI-H子宮內膜癌患者。公開資料顯示,信達生物與和黃醫藥曾在2018年達成合作,開展信迪利單抗與呋喹替尼用于實體瘤聯合治療的研究。2024年4月,復星醫藥的FCN-159片(復邁替尼)上市申請被CDE納入優先審評,擬用于治療成人樹突狀細胞和組織細胞腫瘤。2024年5月,FCN-159片的新適應癥上市申請再次被CDE納入優先審評,用于治療2歲及2歲以上兒童1型神經纖維瘤病(NF1)相關的叢狀神經纖維瘤。FCN-159為一款MEK1/2選擇性抑制劑,可以抑制RAS通路異常引起的腫瘤增殖,擬開發主要用于治療晚期實體瘤、I型神經纖維瘤、樹突狀細胞和組織細胞腫瘤、低級別腦膠質瘤等適應癥。