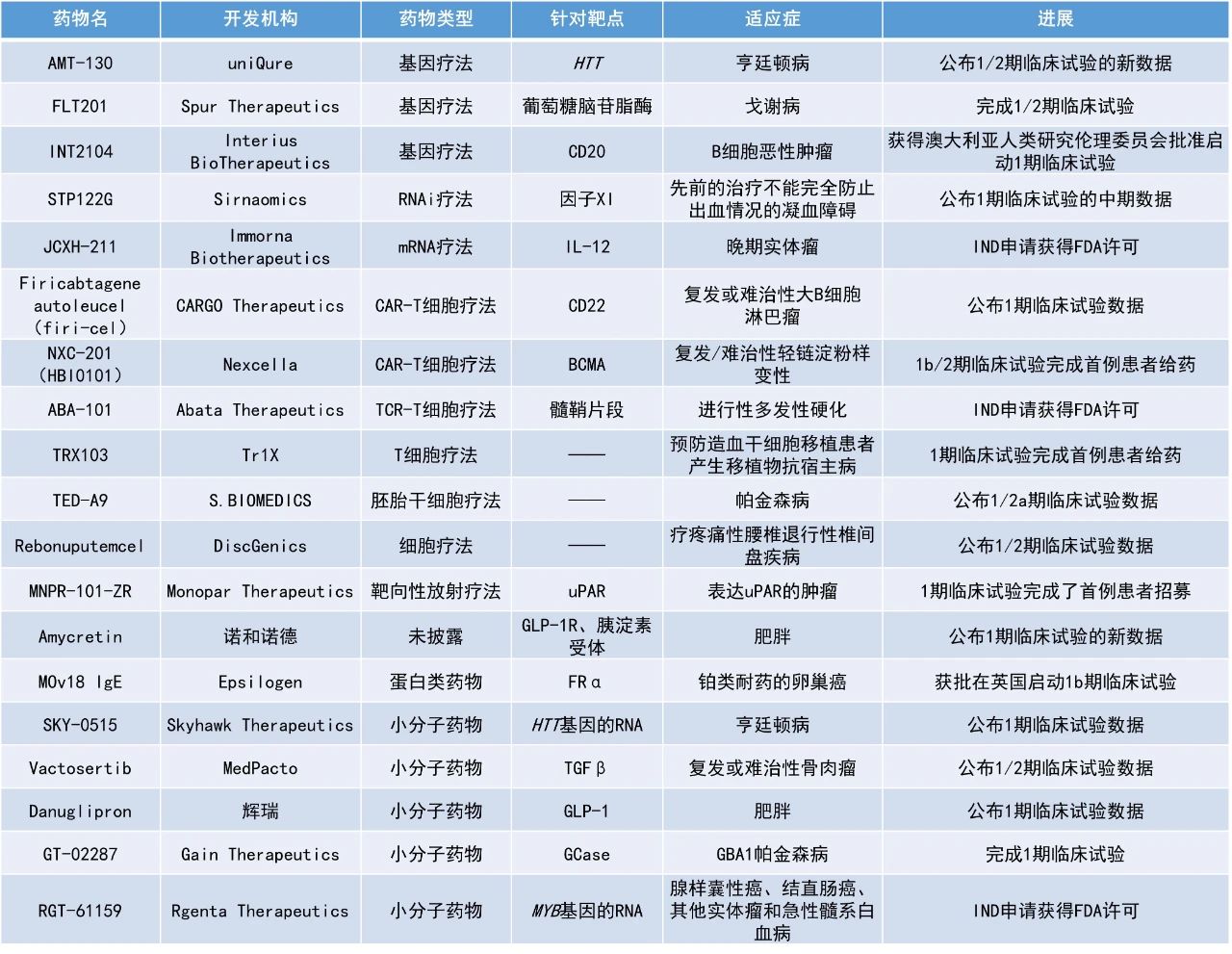
1. 治療對CD19靶向CAR-T細胞療法耐藥的大B細胞淋巴瘤(LBCL)患者的CD22靶向CAR-T細胞療法firi-cel公布積極1期臨床試驗數據,過半患者腫瘤完全消失。
2. 口服GLP-1和胰淀素的長效共激動劑amycretin在一項1期臨床試驗中使肥胖患者在用藥12周后減重超過13.1%。
3. 治療帕金森病的細胞療法TED-A9在一項早期臨床試驗中使3名患者的運動能力獲得顯著改善。
藥明康德內容團隊整理
Firicabtagene autoleucel(firi-cel):公布1期臨床試驗數據
CARGO Therapeutics公司宣布,《柳葉刀》雜志發表了斯坦福大學醫學院進行的一項單中心1期臨床研究的積極數據,該研究評估了CARGO公司的CD22靶向CAR-T細胞療法firicabtagene autoleucel(firi-cel)治療對CD19靶向CAR-T細胞療法耐藥的大B細胞淋巴瘤患者。這款CAR-T療法是由患者自體T細胞經慢病毒載體(m971-BBZ)轉導而制造出來的,目前CARGO Therapeutics擁有它的研發權利。
發布于《柳葉刀》的臨床數據截至2023年5月22日,在中位隨訪時間23.3個月期間,所有接受治療患者的總緩解率(ORR)和完全緩解(CR)率分別為68%和53%。CARGO在今年5月的歐洲血液學協會(EHA)大會上公布了該試驗的更新數據。截至2024年2月1日,在中位隨訪31.4個月期間,所有接受治療患者的ORR和CR率仍分別為68%和53%。其中,29例接受劑量水平1(DL1)治療的患者在中位隨訪29.8個月時的中位總生存期(mOS)為25.7個月(95% CI:9.2-NE),預估的2年生存率為52%。對于達到CR的患者,其中位無進展生存期(PFS)、緩解持續時間和總生存期尚未達到。自2023年11月的最后一次數據截止以來,20名達到CR的患者中沒有觀察到新的復發。此外,在DL1中持續沒有觀察到3級或更高級別的細胞因子釋放綜合征(CRS)或免疫效應細胞相關神經毒性綜合征(ICANS)的發生。新聞稿指出,美國FDA在檢視試驗初步數據后罕見地主動聯系斯坦福醫學中心,敦促其為該療法申請突破性療法認定(BTD)。
Amycretin:公布1期臨床試驗的新數據
諾和諾德(Novo Nordisk)公布了其口服GLP-1和胰淀素的長效共激動劑amycretin的詳細1期臨床試驗結果。分析顯示,試驗12周時,接受最高劑量amycretin的受試者的體重降幅高達13.1%,且受試者的體重下降尚未達到平臺期。根據此積極結果,諾和諾德將對amycretin進行進一步開發。
▲Amycretin在1期試驗中的減重效果(圖片來源:參考資料[6])
行業媒體Fierce Biotech在過去的報道中指出,已過STEP-1臨床試驗結果顯示司美格魯肽組患者在68周試驗期間的體重降幅為14.9%。雖然不同臨床試驗之間的結果難以一同比較,但amycretin在1期試驗早期結果中所展現的快速減重效果,體現了該藥物的巨大潛力。目前諾和諾德正在計劃進行更大規模和更長時間的研究以全面評估amycretin的療效和安全性,其中,旨在評估該療法皮下注射劑型的2期試驗正在進行患者招募。
TED-A9:公布1/2a期臨床試驗數據
S.BIOMEDICS公司宣布了其細胞療法TED-A9在治療帕金森病的1/2期臨床試驗中的首批3名受試者的1年隨訪數據。TED-A9是一款通過對人類胚胎干細胞(hESC)進行小分子化合物處理而生成的高度純化中腦多巴胺能祖細胞。
此次公布的3名接受低劑量TED-A9治療的患者的數據表明了TED-A9的安全性和有效性。患者在細胞植入一年后進行的核磁共振成像(MRI)和CT掃描顯示,細胞移植或手術均未出現相關的不良反應;多巴胺轉運蛋白(DAT)腦成像(FP-CIT-PET)顯示多巴胺轉運蛋白水平增加,意味著多巴胺神經元可能已定植并與患者的帕金森病癥狀改善相關;客觀測量運動功能的MDS-帕金森病統一評定量表(MDS-UPDRS)第III部分評估顯示,平均得分從基線的61.7分下降到一年后治療后的49.0分,改善了12.7分,顯示患者的運動能力得到了顯著的改善。
INT2104:獲得澳大利亞人類研究倫理委員會批準啟動1期臨床試驗
Interius BioTherapeutics公司宣布,已獲得澳大利亞治療用品管理局(TGA)的人類研究倫理委員會(HREC)批準和臨床試驗通知(CTN)許可,以進行其在研體內CAR-T療法INT2104的臨床1期試驗,用以治療B細胞惡性腫瘤。INT2104是一種在研慢病毒載體基因療法,設計靶向CD7陽性的T細胞和NK細胞,并傳遞CAR轉基因,以在體內生成效應CAR-T和CAR-NK細胞。這些CAR細胞靶向CD20陽性B細胞,用于治療B細胞惡性腫瘤。與體外CAR-T療法不同,INT2104是一種現貨型的單劑量療法,可通過靜脈輸注系統性給藥,患者無需進行淋巴清除,治療時不需要任何特殊設備或人員培訓。
該療法在臨床前實驗中展現出積極的抗腫瘤作用。在系統性淋巴瘤小鼠模型中,單次靜脈輸注廣泛劑量范圍的INT2104可實現腫瘤完全消除。在未進行化療預處理的非人靈長類動物中,單次載體輸注后觀察到顯著的B細胞耗竭且沒有觀察到藥物毒性,其中一只動物的B細胞耗竭效果已持續超過6個月。Interius計劃在2024年第四季度開始試驗,并有望在2025年第一季度實現關鍵里程碑。根據行業媒體STAT報道,INT2104是首個進入人體臨床試驗的體內CAR-T療法。
Rebonuputemcel:公布1/2期臨床試驗數據
DiscGenics公司宣布在International Journal of Spine Surgery雜志上發表了同種異體椎間盤祖細胞療法(IDCT)rebonuputemcel治療疼痛性腰椎退行性椎間盤疾病(DDD)的1/2期聯合臨床研究的結果。IDCT是一種獨立的單次注射生物療法,旨在阻止有癥狀的腰椎間盤退行性病變的進展,并使椎間盤由內而外再生。IDCT中的活性成分是從捐贈的成人椎間盤組織中提取的活的祖細胞群。這些細胞經過多步驟的富集和擴增,導致細胞顯著增殖和表型變化。隨后,這些椎間盤源細胞會與粘性透明質酸鈉溶液和輔料混合,成為最終的現貨型細胞療法IDCT。IDCT需要冷凍保存,可在門診環境下經皮注射到椎間盤中使用。IDCT已獲得美國FDA的再生醫學先進療法(RMAT)認定和快速通道資格。
此次公布的結果顯示,該研究達到了主要的安全性和有效性終點,單次椎間盤內注射高劑量IDCT可安全地增加椎間盤體積,并在腰椎間盤退行性病變患者注射后的2年內對患者的背痛、殘疾和生活質量產生具有統計學意義和臨床意義的改善。安全性方面,少數患者(18.3%)報告了嚴重不良事件,其中最高比例的報告來自安慰劑組。
AMT-130:公布1/2期臨床試驗的新數據
uniQure公司宣布其通過大腦直接注射的在研基因療法AMT-130在治療亨廷頓病(HD)的1/2期臨床試驗中獲得積極中期結果。uniQure同時宣布AMT-130獲得針對HD的首個RMAT認定。AMT-130是uniQure首個聚焦中樞神經系統的基因療法,由AAV5載體攜帶專門沉默亨廷頓(HTT)基因表達的微RNA(microRNA),利用該公司專有的miQURE沉默技術,抑制突變亨廷頓蛋白的產生。在這項試驗中,研究人員利用MRI成像引導,將基因療法直接注射到大腦的殼核和尾狀核中。
此次公布的結果顯示,在24個月時,接受高劑量AMT-130治療的HD患者的疾病進展減緩達80%,且其腦脊液(CSF)中的神經絲蛋白輕鏈(NfL)水平顯著低于基線水平。此外,與基線相比,在24個月的隨訪中,接受高劑量AMT-130治療患者的運動和認知功能測量結果幾乎保持穩定。根據迄今為止的數據,AMT-130在兩種劑量下均顯示出良好的耐受性和安全性。沒有報告新的與AMT-130相關的嚴重不良事件。
SKY-0515:公布1期臨床試驗數據
Skyhawk Therapeutics公司公布了SKY-0515在1期臨床試驗A部分和B部分中的積極結果。SKY-0515正被開發為亨廷頓氏病的潛在治療藥物。SKY-0515是Skyhawk公司通過其新型RNA剪接平臺開發的在研小分子RNA剪接修飾劑,旨在減少HTT蛋白和PMS1蛋白。PMS1蛋白是體細胞CAG重復擴增和HD病理學的一個關鍵驅動因素。
此次公布的結果顯示,SKY-0515在健康受試者中顯示出劑量依賴性的HTT mRNA降低,在多劑量遞增研究中,最高劑量組的降低幅度為72%。SKY-0515在所有測試劑量下的耐受性均良好,鑒于這些積極的初步結果,該公司計劃在2024年第三季度在患者組中進行劑量測試,并計劃在明年年初啟動2期研究。
STP122G:公布1期臨床試驗的中期數據
圣諾制藥(Sirnaomics)宣布在研RNAi療法STP122G用于抗凝治療的1期臨床試驗的第二患者隊列圓滿完成,并公布了中期數據。STP122G為第三代靶向凝血因子XI的抗凝血藥物,適用于先前治療不能完全防止出血情況的凝血障礙患者。因子XI是一種主要由肝臟內的肝細胞所產生的酶,其在人體凝血過程中發揮著重要作用。作為一種基于圣諾制藥的GalAhead mxRNA遞送平臺的候選RNAi療法,STP122G以肝細胞為靶點,抑制因子XI的產生,具有長期療效及較小的出血風險。
該臨床試驗的第二患者隊列組由8名健康受試者組成。受試者通過皮下注射完成了50毫克劑量的注射,并接受了140天的隨訪。安全數據顯示, 上一篇:2024年優先審評,17款抗癌新藥被納入,來自.. 下一篇:總緩解率100%!原啟生物GPRC5D CAR-T獲FDA..
四川省醫藥保化品質量管理協會組織召開
2025版《中國藥典》將于2025年10月..關于舉辦四川省藥品生產企業擬新任質量
各相關企業: 新修訂的《中華人..四川省醫藥保化品質量管理協會召開第七
四川省醫藥保化品質量管理協會第七..“兩新聯萬家,黨建助振興”甘孜行活動
為深入貫徹落實省委兩新工委、省市..學習傳達中央八項規定精神專題會議
2025年4月22日,協會黨支部組織召..關于收取2025年度會費的通知
各會員單位: 在過去的一年里,..四川省應對新型冠狀病毒肺炎疫情應急指
四川省應對新型冠狀病毒肺炎疫情應..四川省應對新型冠狀病毒肺炎疫情應急指
四川省應對新型冠狀病毒肺炎疫情應..