本期看點(diǎn)
1. 干細(xì)胞療法VX-880治療1型糖尿病(T1D)患者在早期臨床試驗(yàn)中獲得積極數(shù)據(jù),在末次隨訪時12名患者中有11名減少或停止使用外源性胰島素。
2. 下一代寡核苷酸療法RGLS8429用于治療常染色體顯性多囊腎病的早期臨床試驗(yàn)結(jié)果積極,接受3 mg/kg劑量的患者中有70%的腎臟總體積縮小。
3. 通過抗耗竭技術(shù)增強(qiáng)的CAR-T細(xì)胞療法LYL797在臨床試驗(yàn)中被證明可以浸潤到實(shí)體瘤中,治療ROR1陽性復(fù)發(fā)/難治性三陰性乳腺癌患者的臨床獲益率(CBR)為60%。
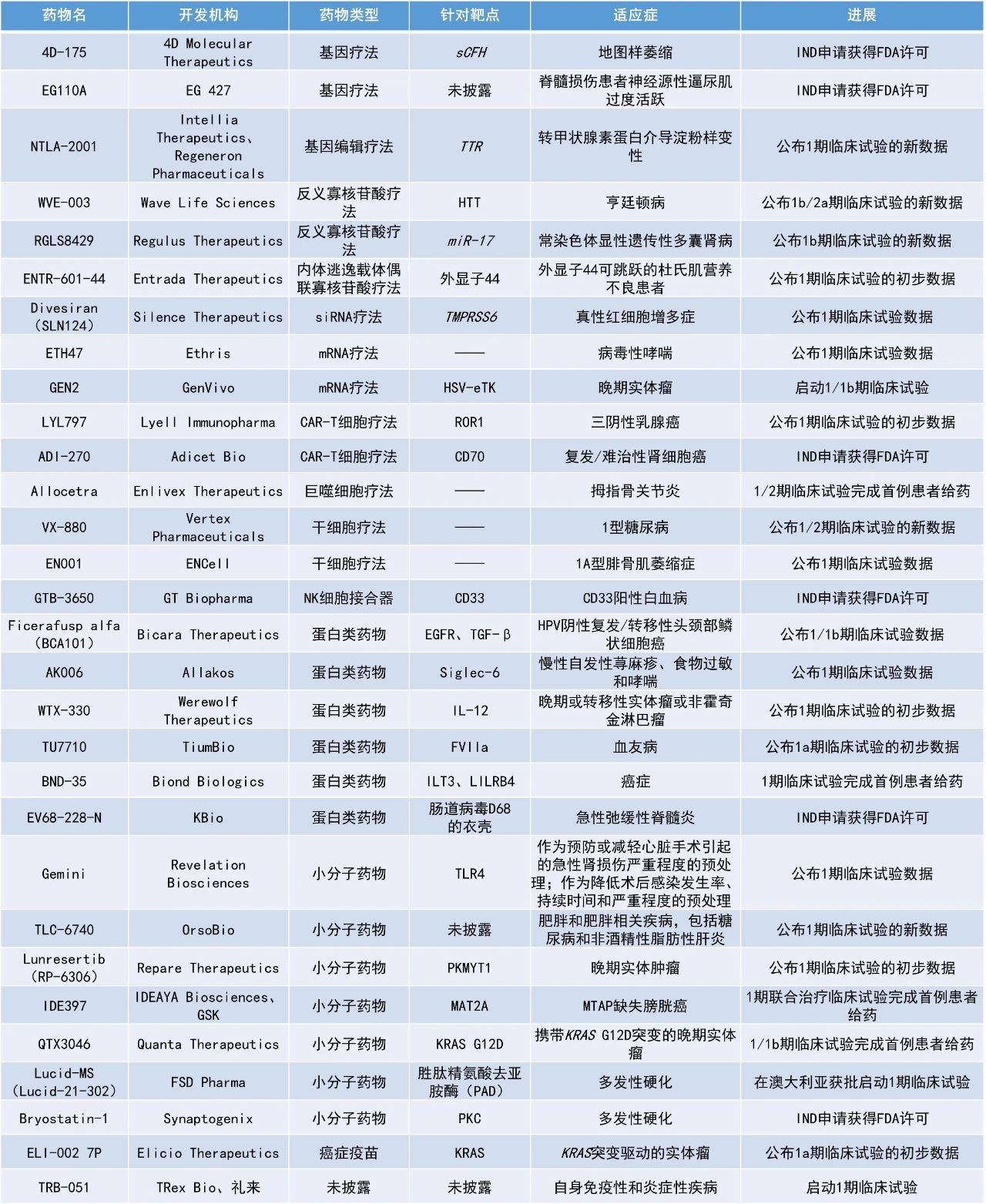
藥明康德內(nèi)容團(tuán)隊(duì)整理
VX-880:公布1/2期臨床試驗(yàn)的新數(shù)據(jù)
Vertex Pharmaceuticals公司公布了其在研細(xì)胞療法VX-880治療1型糖尿病的1/2期臨床試驗(yàn)的最新數(shù)據(jù)。VX-880是一種在研干細(xì)胞來源、完全分化、產(chǎn)生胰島素的同種異體胰島細(xì)胞療法。VX-880有可能通過恢復(fù)胰島細(xì)胞功能,包括葡萄糖反應(yīng)性胰島素產(chǎn)生,恢復(fù)機(jī)體調(diào)節(jié)葡萄糖水平的能力。VX-880通過肝門靜脈輸注給藥,需要長期免疫抑制治療以保護(hù)輸入的胰島細(xì)胞免受免疫排斥。VX-880已獲得美國FDA授予的再生醫(yī)學(xué)先進(jìn)療法(RMAT)認(rèn)定和快速通道資格,以及歐洲藥品管理局(EMA)授予的PRIME資格。
公布的結(jié)果顯示,在接受單次全劑量VX-880輸注后90天內(nèi),所有T1D患者均顯示出胰島細(xì)胞移植成功和對葡萄糖反應(yīng)的胰島素生成。在最后一次隨訪時,12名患者中有11名減少或停止使用外源性胰島素。Vertex預(yù)計(jì)增加入組患者數(shù)量,并將該療法推進(jìn)關(guān)鍵試驗(yàn)階段。
RGLS8429:公布1b期臨床試驗(yàn)的新數(shù)據(jù)
Regulus Therapeutics公司公布了其開發(fā)的新型下一代寡核苷酸療法RGLS8429用于治療常染色體顯性多囊腎病的1b期臨床試驗(yàn)的新數(shù)據(jù)。常染色體顯性多囊腎病是由PKD1或PKD2基因突變引起的,也是最常見的人類單基因疾病之一,同時是終末期腎病的主要原因。RGLS8429旨在抑制miR-17并優(yōu)先靶向腎臟,在臨床前研究中已被證明能夠明顯改善腎臟功能、大小和其他疾病嚴(yán)重程度指標(biāo),并具有優(yōu)越的藥理學(xué)特征。此前,該公司已公布1期單次遞增劑量臨床試驗(yàn)的結(jié)果,結(jié)果顯示,RGLS8429具有良好的安全性、耐受性和藥代動力學(xué)(PK)特征。
此次公布的是1b期研究中第三個隊(duì)列的結(jié)果,患者對RGLS8429的耐受性良好,未發(fā)現(xiàn)安全性問題。PC1和PC2是PKD1和PKD2基因的蛋白質(zhì)產(chǎn)物,已被證明與疾病嚴(yán)重程度呈負(fù)相關(guān)。接受RGLS8429治療患者的PC1和PC2與基線相比的百分比變化在所有測試劑量中均顯示出緩解,與安慰劑相比,3 mg/kg劑量組具有統(tǒng)計(jì)學(xué)意義。探索性成像分析表明,3 mg/kg劑量組的患者中,70%的患者腎臟總體積縮小。
LYL797:公布1期臨床試驗(yàn)的初步數(shù)據(jù)
Lyell Immunopharma公司公布了其第一代重編程ROR1靶向CAR-T細(xì)胞候選產(chǎn)品LYL797的1期臨床試驗(yàn)的初步數(shù)據(jù)。LYL797采用了Lyell公司的抗耗竭基因重編程技術(shù)(c-Jun)和其專有的體外制造方法——表觀遺傳重編程技術(shù)(Epi-R)。LYL797過度表達(dá)c-Jun可以糾正耗竭T細(xì)胞中AP-1家族轉(zhuǎn)錄因子的失衡。在臨床前研究中,c-Jun的過度表達(dá)使T細(xì)胞能夠抵抗耗竭、浸潤實(shí)體瘤并保持其功能。Epi-R技術(shù)旨在生成干樣T細(xì)胞群,減少耗竭,提高增殖和抗腫瘤活性。
該研究的初始數(shù)據(jù)集主要由ROR1陽性復(fù)發(fā)/難治性三陰性乳腺癌患者組成。結(jié)果顯示,LYL797對這些患者具有劑量依賴性的抗腫瘤臨床活性,患者的客觀緩解率為40%,CBR為60%。新聞稿指出,該試驗(yàn)首次證明了通過抗耗竭技術(shù)增強(qiáng)的CAR-T細(xì)胞既可以增殖又可以浸潤到實(shí)體瘤中。在無肺部受累的患者中未觀察到與LYL797相關(guān)的顯著安全信號;在肺轉(zhuǎn)移性疾病患者中觀察到可治療的肺炎。根據(jù)現(xiàn)有的積極數(shù)據(jù),該公司計(jì)劃擴(kuò)大開發(fā)范圍,包括ROR1陽性復(fù)發(fā)/難治性鉑類耐藥卵巢癌、子宮內(nèi)膜癌、多發(fā)性骨髓瘤和慢性淋巴細(xì)胞白血病等新腫瘤類型。
NTLA-2001:公布1期臨床試驗(yàn)的新數(shù)據(jù)
Intellia Therapeutics公司公布了其CRISPR/Cas9基因編輯療法NTLA-2001的最新臨床數(shù)據(jù)。NTLA-2001是Intellia與再生元(Regeneron)開展的多靶點(diǎn)發(fā)現(xiàn)、開發(fā)和商業(yè)化合作的一部分,Intellia負(fù)責(zé)主導(dǎo)NTLA-2001的開發(fā)和商業(yè)化。之前新聞稿指出,NTLA-2001以CRISPR/Cas9技術(shù)為基礎(chǔ),有望成為治療轉(zhuǎn)甲狀腺素蛋白(ATTR)淀粉樣變性的首個單次給藥療法。此外,NTLA-2001是首個通過全身給藥或靜脈注射來編輯人體內(nèi)基因的候選CRISPR基因編輯療法,基于Intellia公司專有的非病毒平臺,利用脂質(zhì)納米顆粒(LNP)向肝臟輸送由兩部分組成的基因編輯系統(tǒng):靶向血清轉(zhuǎn)甲狀腺素(TTR)基因的特異性gRNA和編碼Cas9酶的mRNA。
此次公布的結(jié)果顯示,三位先前在1期劑量遞增研究中接受最低劑量NTLA-2001治療的ATTR淀粉樣變性患者,在接受后續(xù)55 mg NTLA-2001治療后,其TTR蛋白水平中位減少90%。根據(jù)新聞稿,這是首次臨床數(shù)據(jù)顯示體內(nèi)CRISPR/Cas9基因編輯療法可有效重復(fù)給藥,成功完成臨床概念驗(yàn)證。
WVE-003:公布1b/2a期臨床試驗(yàn)的新數(shù)據(jù)
Wave Life Sciences公司宣布,在研療法WVE-003在治療亨廷頓病(HD)的1b/2a期臨床試驗(yàn)SELECT-HD中取得了積極成果。WVE-003是一款等位基因選擇性反義寡核苷酸,旨在降低突變亨廷頓蛋白(mHTT)表達(dá)并保留健康的野生型亨廷頓蛋白(wtHTT)。
數(shù)據(jù)顯示,WVE-003總體安全性和耐受性良好,沒有報(bào)告嚴(yán)重不良事件。在28周評估期間觀察到WVE-003組患者顯著的mHTT蛋白水平降低:在24周(最后一次給藥后8周),腦脊液(CSF)中mHTT與安慰劑組患者相比平均降低46%(p=0.0007);在28周(最后一次給藥后12周),CSF中mHTT平均降低44%(p=0.0002),支持每季度或更少頻率的給藥。尾狀核萎縮是一個影像學(xué)生物標(biāo)志物,可預(yù)測患者的臨床結(jié)果,包括總運(yùn)動評分(TMS)的臨床顯著惡化。在24周(最后一次影像評估)時,mHTT的減少與尾狀核萎縮的減緩相關(guān)(R=-0.50;p=0.047)。
ENTR-601-44:公布1期臨床試驗(yàn)的初步數(shù)據(jù)
Entrada Therapeutics公司公布了其用于治療杜氏肌營養(yǎng)不良(DMD)的候選療法ENTR-601的1期臨床試驗(yàn)的積極初步數(shù)據(jù)。ENTR-601-44是一種專有的內(nèi)泌體逃逸載體(EEV)偶聯(lián)磷酸二酰胺嗎啉寡聚物(PMO),旨在解決由于DMD基因突變或缺失外顯子而導(dǎo)致的DMD的根本原因。ENTR-601-44可用于治療DMD患者中可跳過44號外顯子的患者,目前正在評估其恢復(fù)mRNA閱讀框的潛力,并允許翻譯略有縮短但仍有功能的肌營養(yǎng)不良蛋白。
此次公布的結(jié)果顯示,ENTR-601-44在健康受試者中耐受性良好,沒有嚴(yán)重的不良事件,沒有與藥物相關(guān)的不良事件,也沒有在生命體征、心電圖、體格檢查或?qū)嶒?yàn)室評估中觀察到臨床顯著的變化或趨勢。研究人員在接受ENTR-601-44的患者的肌肉中檢測到了藥物濃度。與接受安慰劑的患者相比,ENTR-601-44組患者的外顯子跳躍水平具有統(tǒng)計(jì)學(xué)意義。
Divesiran(SLN124):公布1期臨床試驗(yàn)數(shù)據(jù)
上一篇:每月一次!羅氏新一代抗體療法獲積極監(jiān)管決定 下一篇:首款TCR-T治療實(shí)體瘤獲批在即,下一代技術(shù)..
四川省醫(yī)藥保化品質(zhì)量管理協(xié)會組織召開
2025版《中國藥典》將于2025年10月..關(guān)于舉辦四川省藥品生產(chǎn)企業(yè)擬新任質(zhì)量
各相關(guān)企業(yè): 新修訂的《中華人..四川省醫(yī)藥保化品質(zhì)量管理協(xié)會召開第七
四川省醫(yī)藥保化品質(zhì)量管理協(xié)會第七..“兩新聯(lián)萬家,黨建助振興”甘孜行活動
為深入貫徹落實(shí)省委兩新工委、省市..學(xué)習(xí)傳達(dá)中央八項(xiàng)規(guī)定精神專題會議
2025年4月22日,協(xié)會黨支部組織召..關(guān)于收取2025年度會費(fèi)的通知
各會員單位: 在過去的一年里,..四川省應(yīng)對新型冠狀病毒肺炎疫情應(yīng)急指
四川省應(yīng)對新型冠狀病毒肺炎疫情應(yīng)..四川省應(yīng)對新型冠狀病毒肺炎疫情應(yīng)急指
四川省應(yīng)對新型冠狀病毒肺炎疫情應(yīng)..