本期看點
1. CD19靶向候選CAR-T細胞療法GLPG5101在1項早期臨床試驗中治療5例套細胞淋巴瘤(MCL)患者,客觀緩解率(ORR)和完全緩解率(CRR)均為100%。
2. 靶向信號調節蛋白(SIRP)的抗體療法ELA026治療初治惡性腫瘤相關噬血細胞性淋巴組織細胞增多癥(mHLH)的總緩解率達100%,并提高了此類患者的兩個月生存率。
3. 抗體療法Natrunix聯用化療治療晚期胰腺癌,在早期臨床試驗中延長了患者的生存期并改善了化療的耐受性。
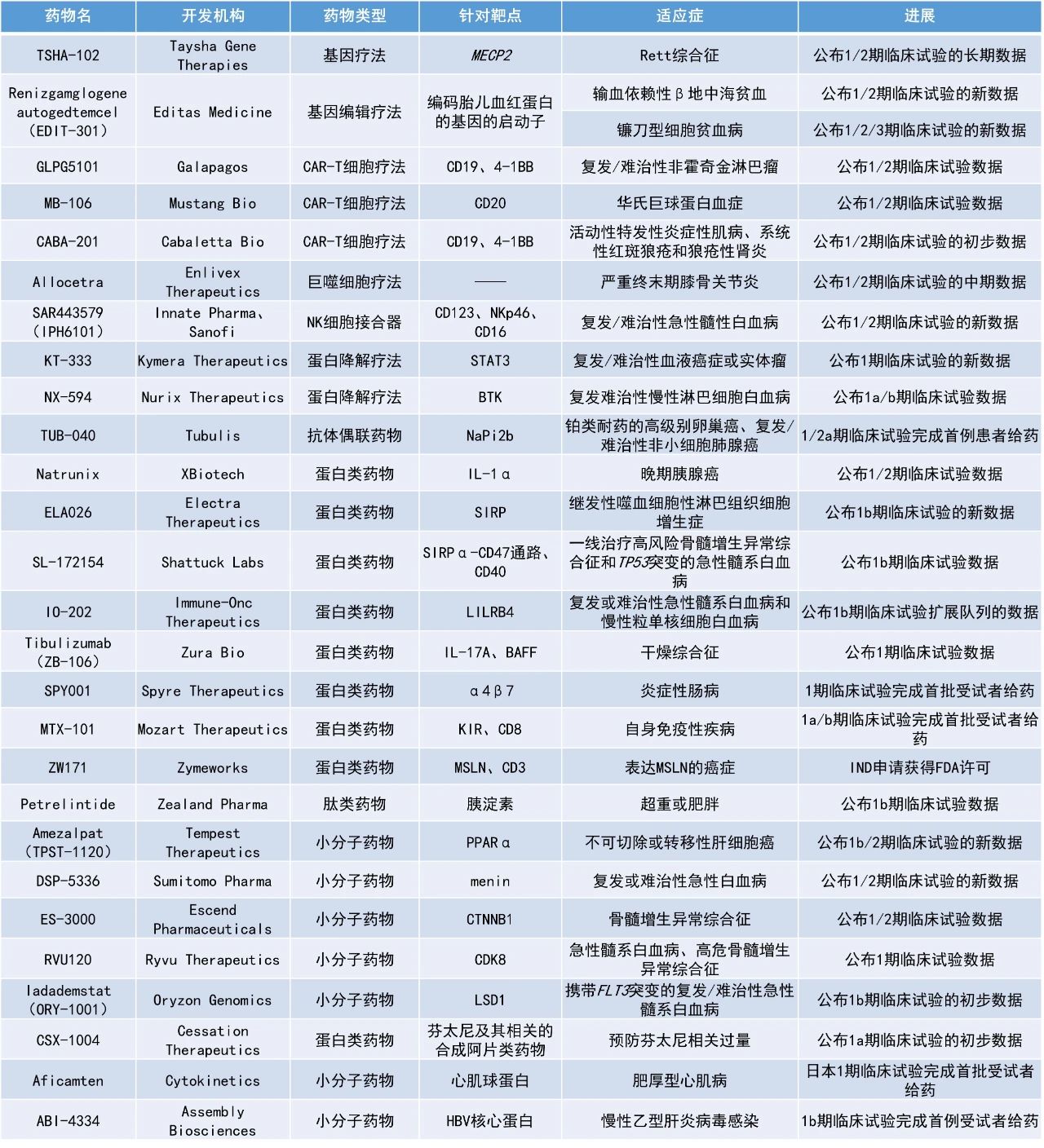
GLPG5101:公布1/2期臨床試驗數據
Galapagos公司公布了其CD19靶向候選CAR-T細胞療法GLPG5101治療復發/難治性非霍奇金淋巴瘤(NHL)的1/2期臨床試驗ATALANTA-1的新數據。該細胞療法從制備到回輸到患者體內的中位時間僅需7天。
截至2023年12月20日的數據,在研究的第一部分,中位隨訪時間為13.1個月,接受GLPG5101治療的16例可評估患者的ORR為87.5%(14/16),CRR為75%(12/16)。71%的患者在數據截止時保持緩解。在研究的第二部分,中位隨訪時間為4.2個月,15例可評估患者的ORR和CRR均為93.3%(14/15)。100%的患者在數據截止時保持持續緩解。合并兩部分的研究結果后根據腫瘤類型進行劃分,彌漫性大B細胞淋巴瘤(DLBCL)患者的ORR為78%(7/9),CRR為56%(5/9);濾泡性淋巴瘤(FL)或邊緣區淋巴瘤(MZL)患者的ORR和CRR均為94%(16/17);套細胞淋巴瘤患者的ORR和CRR均為100%(5/5)。
安全性方面,大多數治療伴發不良事件為1/2級,在研究的第一部分觀察到2例3級細胞因子釋放綜合征(CRS),在研究的第二部分觀察到1例3級免疫效應細胞相關神經毒性綜合征(ICANS)。
ELA026:公布1b期臨床試驗的新數據
Electra Therapeutics公司公布了其靶向信號調節蛋白(SIRP)的單克隆抗體ELA026治療繼發性噬血細胞性淋巴組織細胞增生癥(sHLH)的1b期研究的最新臨床數據。ELA026靶向細胞表面的SIRP,能夠靶向清除血液循環中驅動炎癥的髓系細胞和T細胞,并且不破壞SIRPα/CD47免疫檢查點功能。該療法旨在治療伴有異常髓系和T細胞活性的重度炎性疾病。
此次公布的結果顯示,ELA026在sHLH患者中具有良好的安全性,不良事件可控。在已完成入組的隊列1和2中(n=12),ELA026在第4周時的總緩解率為75%,在8例未接受過治療的mHLH(sHLH的一種亞型)患者中,總緩解率為100%,兩個月時的生存率為88%。此類患者在自然史研究中的兩個月時的死亡率約為50%。
Natrunix:公布1/2期臨床試驗數據
XBiotech公司公布了其靶向白細胞介素-1α(IL-1α)的抗體療法Natrunix聯用化療治療晚期胰腺癌的1/2期多中心研究的數據。除了能夠作為一種抗癌療法,該公司認為Natrunix還有望改善化療的耐受性。該研究中采用的化療方案為ONIVYDE(ON)+5-氟尿嘧啶(5FU)+亞葉酸(LV)。
此次公布的結果顯示,與安慰劑+化療組相比,Natrunix+化療組在24周的治療周期內發生任何類型的不良事件的數量(297例對比336例)、發生重大不良事件的患者比例(9/33對比12/32)和住院天數(80天對比120天)均明顯減少。此外,接受Natrunix+化療組患者的生存期得到了延長,接受治療第330天時有8例患者存活,而安慰劑+化療組沒有患者存活超過330天。
Petrelintide:公布1b期臨床試驗數據
Zealand Pharma公司公布了其在研長效、潛在“best-in-class”減重療法petrelintide的1b期試驗第二部分的頂線結果。Petrelintide(ZP8396)是一種適合每周一次皮下注射的長效胰淀素類似物,具有中性pH下的化學和物理穩定性。胰淀素在胰腺β細胞中產生,并與胰島素一起分泌以響應攝入的營養物質。目前的臨床或臨床前數據表明,petrelintide有潛力實現與GLP-1受體激動劑相當的體重減輕,但具有更好的耐受性,為患者提供更好的用藥體驗和體重減輕,同時保留患者的肌肉質量。
此次公布的結果顯示,患者在接受16周高劑量petrelintide治療后,體重較基線平均減少了8.6%,而安慰劑組僅為1.7%。安全性方面,petrelintide顯示良好的耐受性,沒有出現嚴重的不良事件。所有胃腸道(GI)不良事件均為輕度,除了一名受試者在第三次治療后因中度惡心和嘔吐而停止治療。值得注意的是,沒有其他受試者因不良事件停止治療或報告嘔吐,只有兩例輕度腹瀉報告。惡心在活性組中報告比例為16.7-33.3%,在安慰劑組為16.7%。少數參與者報告了注射部位反應,均為輕度。未觀察到患者產生抗藥抗體。新聞稿指出,該積極結果支持petrelintide作為GLP-1受體激動劑類藥物之外,在體重管理上的另一選擇。
Amezalpat(TPST-1120):公布1b/2期臨床試驗的新數據
Tempest Therapeutics公司公布了其在研口服、選擇性小分子PPAR?拮抗劑amezalpat(TPST-1120)在一項全球隨機的1b/2期臨床試驗中獲得的積極結果。臨床前數據顯示,amezalpat可直接殺死腫瘤細胞,并靶向腫瘤微環境中的抑制性免疫通路。這兩種類型中的靶向細胞皆依賴脂肪酸代謝,該代謝過程由PPARα轉錄因子調節。在一項針對接受過多次治療的晚期實體瘤患者的1期臨床試驗中,amezalpat單藥治療和與PD-1抑制劑nivolumab聯合應用均導致腫瘤縮小及生物標志物的變化。
此次公布的結果顯示,與標準治療方案相比,amezalpat與標準治療方案(抗PD-L1抗體atezolizumab和抗VEGF抗體bevacizumab)聯用,在無法切除或轉移性肝細胞癌(HCC)患者的一線治療中,顯著提高患者的中位總生存期(OS)達6個月(21個月對比15個月)。此外,按照RECIST v1.1標準評估,amezalpat組的確認客觀緩解率(cORR)為30%,對照組為13.3%。安全性方面,amezalpat的耐受性良好,兩組之間的安全數據相當。
MB-106:公布1/2期臨床試驗數據
Mustang Bio公司公布了其在研、可通過門診給藥、靶向CD20的自體CAR-T細胞療法MB-106治療華氏巨球蛋白血癥(WM)的1/2期臨床試驗最新數據。該試驗中的所有十例患者均曾接受過布魯頓酪氨酸激酶抑制劑(BTKi)的治療,并且在接受BTKi治療期間病情持續惡化。患者之前接受過中位9線療法,只有一例患者在接受MB-106治療后開始接受額外的抗WM治療。
總體而言,接受MB-106治療的患者中有90%(9/10)對治療產生應答,包括3名患者達完全緩解(CR)、2名達非常好的部分緩解和4名部分緩解。此外,1例患者的病情穩定。其中一名獲得CR的患者已持續緩解31個月,該患者的免疫球蛋白M(IgM)水平在接受MB-106治療后迅速降至正常范圍,此后一直保持正常。
安全性方面,9例患者發生了CRS(5例患者為1級,
四川省醫藥保化品質量管理協會組織召開
2025版《中國藥典》將于2025年10月..關于舉辦四川省藥品生產企業擬新任質量
各相關企業: 新修訂的《中華人..四川省醫藥保化品質量管理協會召開第七
四川省醫藥保化品質量管理協會第七..“兩新聯萬家,黨建助振興”甘孜行活動
為深入貫徹落實省委兩新工委、省市..學習傳達中央八項規定精神專題會議
2025年4月22日,協會黨支部組織召..關于收取2025年度會費的通知
各會員單位: 在過去的一年里,..四川省應對新型冠狀病毒肺炎疫情應急指
四川省應對新型冠狀病毒肺炎疫情應..四川省應對新型冠狀病毒肺炎疫情應急指
四川省應對新型冠狀病毒肺炎疫情應..