上半年,FDA批準多款具有里程碑意義藥物,看點頗多:
40年來首款非酒精性脂肪性肝炎藥物Rezdiffra獲批上市;時隔32年,又一款應用于腫瘤免疫治療的細胞因子藥物Anktiva獲批上市等等。
截至目前,2024年上半年CDER批準了18個新分子實體,其中包括13款化藥新藥和5款生物藥新藥。
值得一提的是,今年上半年的新藥獲批數量明顯少于去年,2023年同期已有20多款新分子實體獲批,主要是化藥新藥上市數量減少(去年同期有17款化藥新藥上市)。
表1 2024上半年,CDER批準的化藥新藥
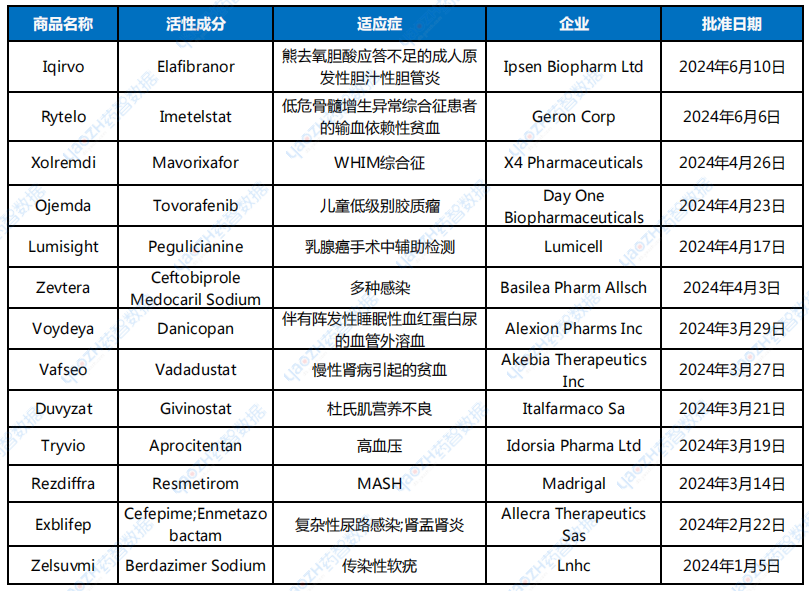
數據來源:FDA、藥智數據
從審批方式看,獲批的13款新化藥中Iqirvo、Xolremdi、Ojemda等8款藥物是通過優先審評上市,與NDA標準審批需要10個月相比,優先審評需在6個月內完成,節省了企業的時間成本,同時優先審評的藥物具有更高的治療價值。
從適應癥上來看,代謝類疾病治療領域有4款,腫瘤領域有3款,免疫治療領域有2款,抗感染領域有2款,神經系統和其他領域各1款。在獲批的化藥新藥中孤兒藥有6款,占比接近一半,可見罕見病研發領域依舊火熱。
下面簡要介紹幾款獲批上市的新化藥。
Iqirvo(Elafibranor)
6月10日,益普生宣布美國FDA已加速批準Iqirvo,Iqirvo是同類首創的口服、每日一次的過氧化物酶體增殖激活受體(PPAR)激動劑,用于治療對UDCA應答不足的成人原發性膽汁性膽管炎(PBC),或作為單藥療法治療對UDCA不耐受的患者。
這是近十年來首個獲批治療罕見肝病原發性膽汁性膽管炎的新藥。
PBC是因為膽管的慢性損傷,導致清除毒素的能力下降,引發肝硬化和肝功能衰竭。根據關鍵性3期試驗ELATIVE結果顯示只有接受elafibranor治療的患者在第52周堿性磷酸酶(ALP)達到正常值,與對照組相比降低幅度達到41%。目前治療罕見自身免疫性PBC患者、治療PBC的炎癥、膽汁淤積和纖維化等研究正在進行。
值得一提,同靶點藥物Seladelpar,已獲得FDA優先審評資格,預計8月份公布審評結果。
Rytelo(Imetelstat)
6月6日,Geron Corporation的Rytelo被FDA獲批上市,用于治療低危骨髓增生異常綜合征(LR-MDS)患者的輸血性依賴性貧血。MDS指阻礙血液(造血)干細胞成熟為健康血細胞的一組癌癥,是一種罕見的血癌。如果患者體內沒有足夠的健康血細胞,可能會出現貧血、頻繁感染和失控出血等嚴重疾病。
Rytelo是一款first in class端粒酶抑制劑,Imetelstat通過結合并抑制端粒酶,從而調控惡性造血干細胞的凋亡。1990年Geron成立,從開始研發端粒酶抑制劑到Rytelo上市,Geron花了30多年,在經歷一系列的失敗之后,Imetelstat終于在MDS上有了用武之地;3期IMerge研究顯示Imetelstat治療后無需輸血的比例顯著高于安慰劑組。
Xolremdi(Mavorixafor)
4月26日,X4 Pharmaceuticals公司宣布美國FDA批準Xolremdi(mavorixafor)膠囊上市,用于治療12歲及以上患有WHIM綜合征的患者,以增加血液循環中成熟中性粒細胞和淋巴細胞的數量。這是首款獲批針對WHIM綜合征患者的小分子療法。WHIM綜合征是一種罕見的原發性免疫缺陷和慢性中性粒細胞減少癥,由CXC趨化因子受體4(CXCR4)信號通路障礙引起。
Xolremdi是一種選擇性CXCR4拮抗劑,關鍵3期臨床4WHIM研究結果顯示,與安慰劑相比,Xolremdi治療顯著增加了中性粒細胞計數(ANC)水平超過閾值(≥500細胞/微升)和絕對淋巴細胞計數(ALC)水平超過閾值(≥1000細胞/微升)的持續時間,安全性良好。
此前,Xolremdi已經被FDA授予突破性療法認定。
Ojemda(Tovorafenib)
4月23日,FDA加速批準Day One Biopharmaceuticals開發的泛RAF激酶抑制劑Ojemda(tovorafenib)上市,用于治療6個月及以上的復發或難治性兒童低級別膠質瘤(pLGG)患者,這些患者存在BRAF融合或重排,或BRAF V600突變。Ojemda是用于治療該疾病的全身療法,它能夠抑制攜帶BRAF融合或BRAF V600突變的腫瘤的生長,并且具有大腦滲透性。先前被FDA授予突破性療法和罕見兒科疾病資格,這也是基于FIREFLY-1臨床2期試驗數據獲批的原因之一。
兒科低級別膠質瘤是兒童中最常見的腦瘤,在美國,兒童LGG年發病率為每十萬人1.3~2.1例,預計每年有1000-1600例新發病例。2023年3月16日,FDA批準了諾華的BRAF/MEK組合即Tafinlar(dabrafenib,達拉非尼)聯合Mekinist(trametinib,曲美替尼),這是pLGG的首個靶向療法。
Rezdiffra(Resmetirom)
3月14日,MASH治療領域迎來重大進展,FDA批準Madrigal的口服小分子藥物Rezdiffra用于治療伴有中度至晚期肝瘢痕形成(纖維化)的代謝功能障礙相關脂肪性肝炎成人患者,配合飲食、運動一起使用。這是40年來首款獲批上市的MASH藥物。
Resmetirom是一款甲狀腺激素受體(THR)-β口服選擇性激動劑。THR-β在人體肝臟中高表達,能夠調節脂代謝,降低LDL-C、甘油三酯和致動脈粥樣硬化性脂蛋白,THR-β還可以通過促進脂肪酸的分解和刺激線粒體的生物發生來減少脂肪毒性并改善肝功能,進而減少肝臟脂肪。
表2 2024上半年,CDER批準的生物藥新藥
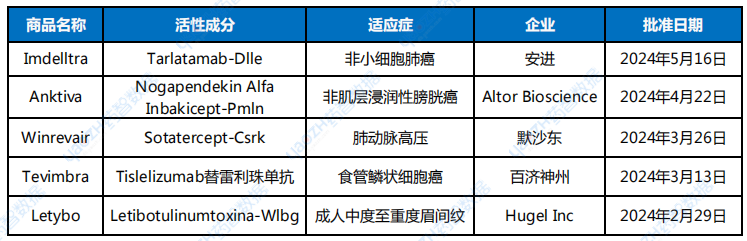
數據來源:FDA、藥智數據
截至目前,2024年上半年CDER共批準了5款生物藥新藥,1款雙抗(Imdelltra),1款細胞因子藥物(Anktiva),1款融合蛋白(Winrevair),1款單克隆抗體(Tevimbra),1款神經毒素(Letybo)。
從治療領域來看,在獲批的5款生物藥新藥中,占比最多是癌癥治療領域,有Imdelltra、Anktiva、Tevimbra 3款新藥上市,值得注意的是國產創新藥企百濟神州的Tevimbra(替雷利珠單抗)成功登陸美國市場成為第二款在美上市的PD-1藥物;代謝領域有一款Winrevair,另外還有一款醫美藥物Letybo上市。
Anktiva
4月22日,ImmunityBio公司宣布FDA已經批準Anktiva聯合卡介苗(BCG),用于治療卡介苗不響應的非肌層浸潤性膀胱癌(NMIBC)伴原位癌(CIS),伴或不伴乳頭狀瘤患者,成為全球首個獲批的白細胞介素-15(IL-15)藥物,這是美國FDA時隔32年后批準的又一款應用于腫瘤免疫治療的細胞因子藥物,也是歷史上的第三款。
Anktiva是一種IL-15超激動劑復合物,由IL-15突變體與IL-15R&alp
四川省醫藥保化品質量管理協會組織召開
2025版《中國藥典》將于2025年10月..關于舉辦四川省藥品生產企業擬新任質量
各相關企業: 新修訂的《中華人..四川省醫藥保化品質量管理協會召開第七
四川省醫藥保化品質量管理協會第七..“兩新聯萬家,黨建助振興”甘孜行活動
為深入貫徹落實省委兩新工委、省市..學習傳達中央八項規定精神專題會議
2025年4月22日,協會黨支部組織召..關于收取2025年度會費的通知
各會員單位: 在過去的一年里,..四川省應對新型冠狀病毒肺炎疫情應急指
四川省應對新型冠狀病毒肺炎疫情應..四川省應對新型冠狀病毒肺炎疫情應急指
四川省應對新型冠狀病毒肺炎疫情應..