美國 FDA 外周和中樞神經系統藥物專家會于兩個小時前剛剛結束,以 11 票對 0 票一致推薦批準禮來公司用于治療早期阿爾茨海默病的藥物 donanemab,裁定該藥減緩患者認知能力下降的療效超過了其安全性風險。
對于 Donanemab 的監管決定已經推遲了兩次,禮來最初表示預計 FDA 于 2023 年底作出決定,但后來推遲到今年第一季度,今年三月份 FDA 再次決定推遲作出審批決定的日期,并要求召開專家會討論。在經過一天的討論后,這一投票結果對于禮來是最好的情況,這使得 FDA 很可能會批準 donanemab 用于因阿爾茨海默而被診斷為輕度認知障礙的廣大人群。FDA 預計將于今年晚些時候做出決定。禮來公司股價上漲了 2%。
在專家會的報告上,FDA 介紹了有關 donanemab 安全性的幾個懸而未決的問題,但似乎最有可能采取的方式是在標簽上強調藥物的風險,而不是阻礙批準。專家組成員,斯坦福大學神經學家 Kathleen Poston 表示,“只要風險受到監控,獲益就大于風險。”
Donanemab 的作用原理是清除大腦中的有毒斑塊 — 淀粉樣蛋白。如果獲得批準,這將是繼衛材和渤健的同類抗體 Leqembi 之后第二個上市的此類藥物。
FDA 請求專家組成員討論將該藥的使用限制在 tau 蛋白達到一定水平的患者中的可能性。禮來在試驗中測量了這種蛋白。最終,許多專家決定,由于必須對患者進行 tau 蛋白掃描存在實際挑戰,因此不應要求評估 tau 蛋白。
雖然專家們投票認為這些藥物的整體獲益大于風險,但專家們也確實對一小部分擁有兩個 APOE4 基因變異副本的患者的風險表示擔憂,因為這些患者更有可能在淀粉樣蛋白清除治療中出現腦腫脹的副作用。專家還對非裔美國人和拉美人群在禮來試驗中的代表性較低表示擔憂。
專家組對于禮來在試驗中采取的獨特方法(即,停止對淀粉樣斑塊已清除患者的治療)提出了質疑。專家們表示,雖然這是一種創新方法,但現實世界中如何實施仍存在不確定性,例如,患者停止用藥后治療效果能持續多久,患者應多久接受一次監測以確定是否需要重新開始治療。
將禮來的 donanemab 與衛材/渤健的 Leqembi 相比,donanemab 在試驗中顯示出比 Leqembi 在其臨床試驗中更高的療效,但禮來的藥也與更高的腦腫脹和腦微小出血相關。Donanemab 每月通過靜脈輸注給藥一次;Leqembi 需要每兩周輸注一次。不過衛材和渤健已開發出一種新的 Leqembi 皮下注射劑型。
在 donanemab 的關鍵 3 期試驗中,tau 水平低至中度的患者似乎獲得了最大獲益,根據 iADRS(綜合阿爾茨海默病評定量表)的衡量病情減緩了 35%, 根據 CDR-SB(臨床癡呆評定量表-總計分)的傳統評價表病情減緩了 36%。(見下圖)
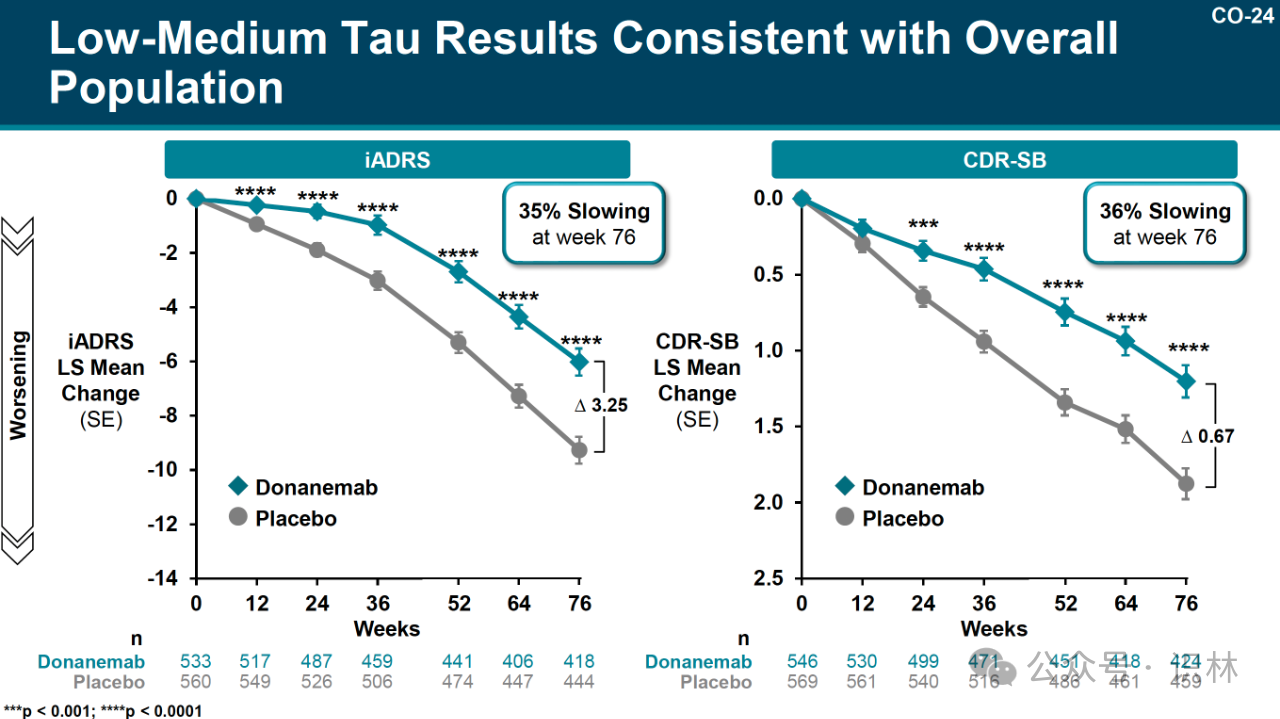
縱觀所有參加試驗的患者,其中包括 tau 水平低至中度和高度的患者,donanemab 在 iADRS 上使病情減緩了 22%,在 CDR-SB 上使病情減緩了 29%。(見下圖)
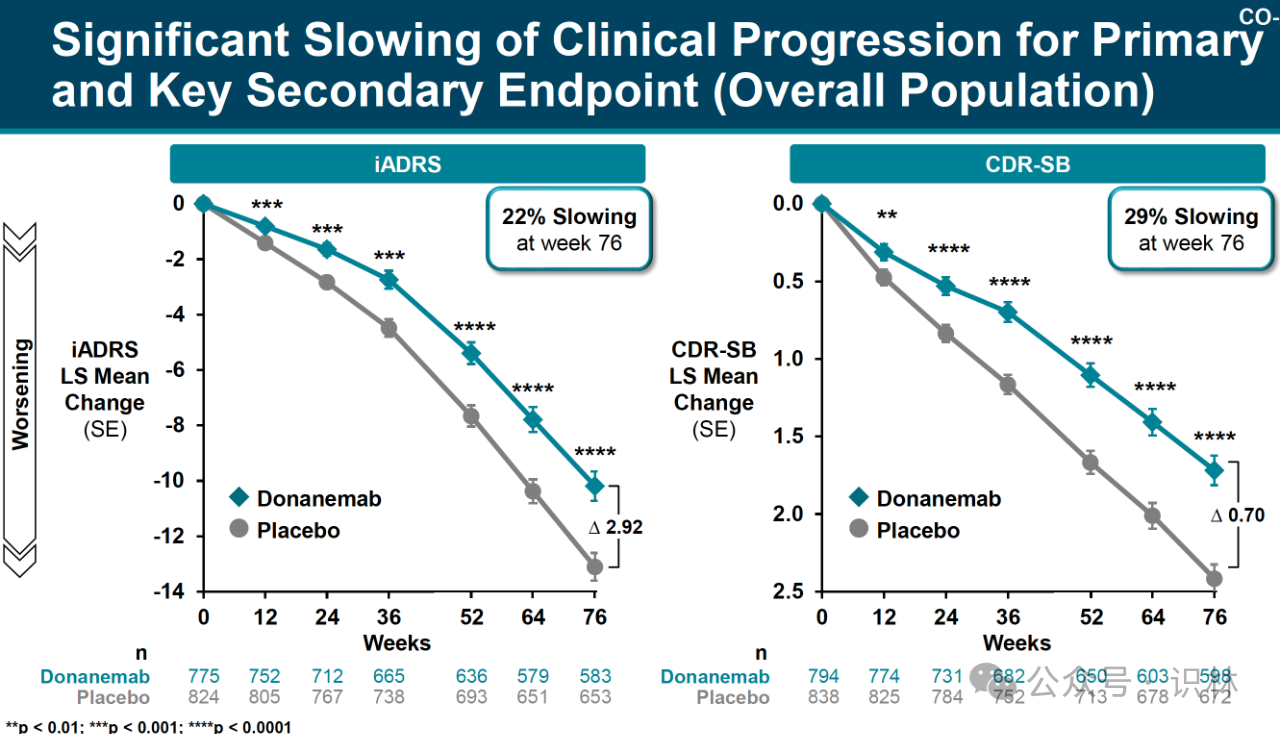
Tau 水平為零或較低的患者被排除在試驗之外,但這些患者被納入了一項補充研究,根據生物標志物測量結果,他們在研究中經歷了積極的治療應答。一些專家表示擔心,tau 水平為零或較低的患者的數據較少,不過專家們也表示,附錄研究中的生物標志物數據讓他們感到放心,而且在現實生活中對患者進行 tau 掃描非常困難,尤其是會增加患者負擔無法做到公平。
專家組成員、梅奧診所神經科學系主任 Nilüfer Ertekin-Taner 表示,“納入正電子發射斷層掃描(PET)tau 蛋白的要求將進一步限制能夠獲得這類藥物的患者數量。這是一個微妙的情況,一方面,我們確實需要有關沒有和非常低 tau 蛋白的人群的額外數據,另一方面,我們不應該要求進行 tau PET 檢查才能獲得這些藥物。”
四川省醫藥保化品質量管理協會組織召開
2025版《中國藥典》將于2025年10月..關于舉辦四川省藥品生產企業擬新任質量
各相關企業: 新修訂的《中華人..四川省醫藥保化品質量管理協會召開第七
四川省醫藥保化品質量管理協會第七..“兩新聯萬家,黨建助振興”甘孜行活動
為深入貫徹落實省委兩新工委、省市..學習傳達中央八項規定精神專題會議
2025年4月22日,協會黨支部組織召..關于收取2025年度會費的通知
各會員單位: 在過去的一年里,..四川省應對新型冠狀病毒肺炎疫情應急指
四川省應對新型冠狀病毒肺炎疫情應..四川省應對新型冠狀病毒肺炎疫情應急指
四川省應對新型冠狀病毒肺炎疫情應..