國際藥品認證合作組織(PIC/S)于 4 月 26 日重新發布了其 GMP 指南,主要修訂為將原 GMP 指南的附錄 2 《人用生物原料藥與藥品的生產》稍作修訂變為附錄 2B,新增附錄 2A《人用先進治療醫藥產品的生產》。此次修訂版本將于 2021 年 5 月 1 日生效。
在先進治療醫藥產品(Advanced Therapy Medicinal Products, ATMP)制造中所采用的方法是實現相應監管控制的關鍵因素。因此,PIC/S 表示,可以在很大程度上參考 ATMP 的制造方法來定義 ATMP。例如,對于基因療法 ATMP,可以通過多種方法(例如,病毒和非病毒載體,mRNA,離體和體內基因組編輯工具)獲得遺傳修飾。遺傳修飾的細胞可以是人類來源(自體或同種異體)或動物來源(異種細胞),可以是原代或已建立的細胞系。
拆分附錄 2 的想法是由一個 PIC/S 工作組與世界衛生組織(WHO)的代表于 2018 年提出。PIC/S 解釋指出,創建一個以 ATMP 為重點的附錄將使 PIC/S 能夠考慮到在這一快速發展領域中的國際發展,同時還使 PIC/S 能夠解決有關患者安全性和 ATMP 法規適用性的問題。【PICS 擬拆分 GMP 附錄 2 以包括先進治療產品 2019/10/07】
PIC/S GMP 附錄 2A 針對 ATMP 的全部范圍,以及其制造中使用的活性物質提供了額外和針對性的指導。附錄適應于研究用 ATMP 以及上市許可的 ATMP。此外,在國家法律授權的情況下,還可以用于醫院環境中的 ATMP 制造以及同情使用程序。該附錄應與 PIC/S GMP 指南正文以及其它附錄結合使用。
PIC/S 在指南中強調,這一領域正在迅速變化,可能需要進行修訂以適應技術變化,澄清不確定性或明確認可重要的替代方案。因此,PIC/S 歡迎各方在該附錄生命周期的任何階段發表反饋意見。
附錄分為兩個主要部分:
1. A 部分包含有關 ATMP 制造的補充指南和替代規定,從種子批和細胞庫控制到封裝完成活動和檢測。
2. B 部分包含有關選定類型的 ATMP 及其原液的進一步指南。
適用范圍
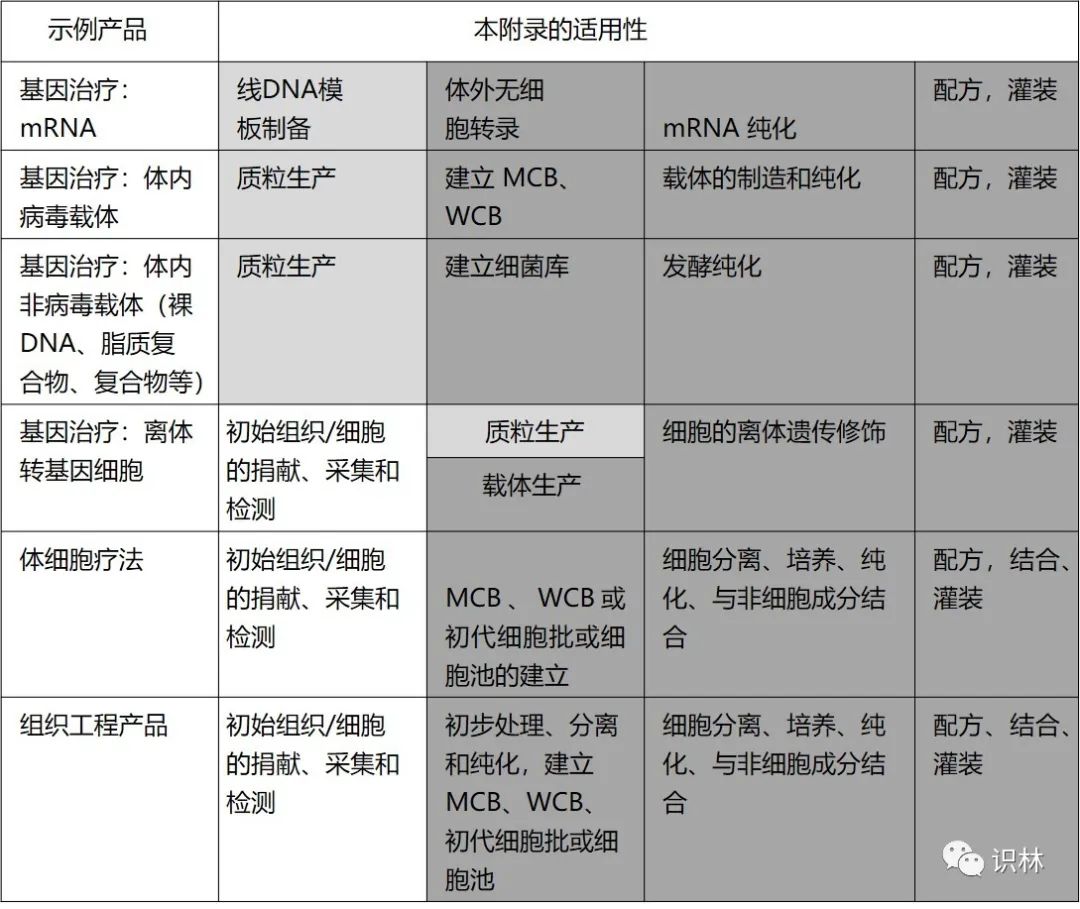
PIC/S 用表格的形式給出了該附錄在生產活動中適用位置的示例(見下表,該附錄適用于深灰色所示的制造步驟,附錄或附錄原則對淺灰色所示步驟的適用性取決于國家法規的要求)。該表僅是說明性的并不意味著確切范圍。ATMP 原液生產從早期階段到后期階段,GMP 要求的水平不斷提高。在該附錄范圍內包括某些生產的早期步驟,但并不意味著這些步驟將定期接受監管當局的檢查。
原則
ATMP 的制造涉及某些特定的考慮因素,這些考慮是由產品和過程性質帶來的。生物醫藥產品的制造、控制和管理方式需要采取一些特殊的預防措施。
由于制造過程中使用的材料和加工條件旨在為特定細胞和微生物的生長提供條件,這為外來微生物污染物(例如細菌、真菌)的生長提供了機會。另外,某些產品承受多種純化技術的能力可能會有限制,特別是那些旨在滅活或去除外源病毒污染物的純化技術。工藝、設備、設施、公用系統的設計,緩沖液和試劑的制備和添加條件,操作人員的取樣和培訓是使此類污染事件降至最低(即,工程和技術控制)的關鍵考慮因素。另外,制造過程需要進行良好的設計和控制,以免增加產品的變異性。
產品規格,例如藥典各論、CTA 和 MA 中的規格,將決定物質和材料是否以及在哪個制造階段可以具有確定的生物負荷水平或需要無菌。同樣,制造必須與 CTA 或 MA 中規定的其它規范(例如,種子批或細胞庫之間的世代數(倍增,傳代))保持一致。
對于無法滅菌(例如,通過過濾)的生物物料,必須進行無菌操作以最大程度地減少污染物的引入。應參考其它指南文件(如果有的話)以驗證特定的制造方法(例如 , 病毒清除或病毒滅活)。適當的環境控制和監測以及在可行的情況下,原位清潔和滅菌系統的應用以及封閉系統和無菌一次性產品接觸設備的使用,可以大大降低意外污染和交叉污染的風險。
ATMP 需要結合獨特的生物學方法和標準的理化分析來進行質量控制(QC)。對于許多基于細胞的產品 , 起始物料引入的變異性無法通過制造過程或中間過程控制(IPC)克服。對起始物料和原輔料的充分控制,對 ATMP 活性物質的明確定義以及 ATMP 藥物產品的放行檢測是質量控制的關鍵部分。控制措施應考慮到制造 ATMP 所需的生物材料的內在變異性。因此 , 穩健的制造過程至關重要,并且中間過程控制在生物原液和醫藥產品的制造中尤為重要。
作者:識林-椒
四川省醫藥保化品質量管理協會組織召開
2025版《中國藥典》將于2025年10月..關于舉辦四川省藥品生產企業擬新任質量
各相關企業: 新修訂的《中華人..四川省醫藥保化品質量管理協會召開第七
四川省醫藥保化品質量管理協會第七..“兩新聯萬家,黨建助振興”甘孜行活動
為深入貫徹落實省委兩新工委、省市..學習傳達中央八項規定精神專題會議
2025年4月22日,協會黨支部組織召..關于收取2025年度會費的通知
各會員單位: 在過去的一年里,..四川省應對新型冠狀病毒肺炎疫情應急指
四川省應對新型冠狀病毒肺炎疫情應..四川省應對新型冠狀病毒肺炎疫情應急指
四川省應對新型冠狀病毒肺炎疫情應..