編輯說:國家十三五規劃提出了“健康中國”的目標,而于今年8月11日分布的《中醫藥發展“十三五”規劃》,都顯示出國家大力發展中醫藥文化,推動中醫藥走向世界,中藥現代化、國際化已成為不可阻擋的趨勢。與此同時,隨著人們健康意識的日益提高,重要臨床療效和安全性成為社會普遍關注的問題。中藥上市后再評價是大趨勢,也是涉足中醫藥領域的企業高度重視的問題。

中國中醫科學院中醫臨床基礎醫學研究所常務副所長 謝雁鳴
中藥上市后再評價研究在我國取得初步成果
在第28屆全國醫藥經濟信息發布會上,中國中醫科學院中醫臨床基礎醫學研究所常務副所長謝雁鳴為我們詳細解讀了《中成藥上市后再評價與臨床合理用藥》, “中藥上市后再評價真正開展起來不過10余年時間,但已有較大發展,影響日益深遠。”謝雁鳴指出,中藥上市后再評價研究越來越受到制藥企業的重視,已經逐步開展。
中藥上市后再評價的相關法規從最初的簡單規定,到后來對內容和方法的規范,并與醫保、基藥、中保目錄的遴選以及藥物再注冊制度相銜接,是一個從認識上逐步具體和深入的過程。
謝雁鳴教授說,在古代,中藥藥效、不良反應評價以《本經》為代表。時至今日,各地中藥注射劑安全性再評價及風險評估工作方案陸續出臺:
2001年12月《中華人民共和國藥品管理法》第三十三條規定開展上市后再價;2009年1月關于開展中藥注射劑安全性再評價工作的通知及工作方案,《中藥注射劑安全性再評價生產工藝評價技術原則(試行)》等7個技術原則,以規范和指導中藥注射劑安全性再評價工作。
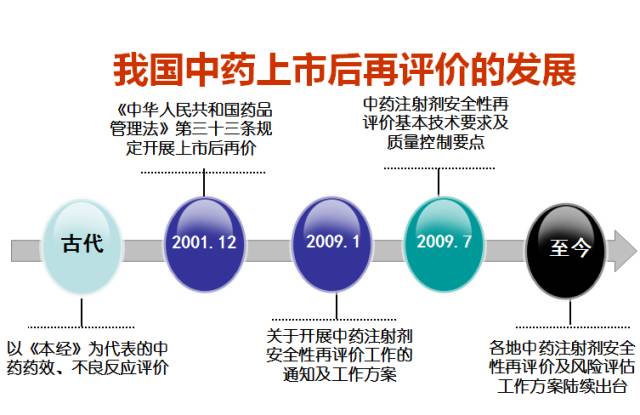
我國中藥上市后再評價的發展
政策利好推動獨家中藥增加再評價研究的投入
2016年2月14日,國務院召開常務會議,部署推動醫藥產業創新升級,會議確定加大中醫藥投入和政策扶持,在國家基本藥物目錄中增加中成藥品種數量。
謝雁鳴指出,我國基本藥物目錄遴選是根據《國家基本藥物目錄管理辦法》(2009)要求,其中,咨詢專家組根據循證醫學、藥物經濟學對納入遴選范圍的藥品進行技術評價,提出遴選意見,形成備選目錄。我國醫保目錄遴選是根據《城鎮職工基本醫療保險用藥范圍管理暫行辦法》(1999),其中提到,在全國范圍內選擇專業技術水平較高的臨床醫學和藥學專家,組成藥品遴選專家組,負責遴選藥品。
對于我國中藥保護品種申報,在《中藥保護品種指導原則》(2009)要求指出,申報資料要有上市后的研究資料,包括不良反應監測情況及質量標準執行情況等相關資料。應開展以廣泛應用的安全性評價為目的的臨床研究,二級甲等醫院可參加研究。在安全性評價中,應注重常規安全性觀察,如三大常規檢查、肝腎功能、心電圖檢查等,以及與品種自身特點和主治適應癥有關的特殊安全性觀察,如含有配伍禁忌品種、前期研究提示有特殊毒性品種、注射劑等。

我國中藥保護品種申報
以龍心®芪龍膠囊為例,其組方源于補陽還伍湯,采用清華大學專利技術,由中國中醫科學院進行臨床研究;其作為國家重點新產品、獨家產品,并有清華專利,享受國家行政保護,在臨床應用超過十年,效果追蹤,療效顯著。謝雁鳴表示,該藥在上市后進行了二次開發,從藥學、藥理、臨床進行相關研究,并構建大品種培育路徑,充分挖掘產品的特色與潛力,在醫保政策、招標政策、新藥政策等方面都做了相關的提升。
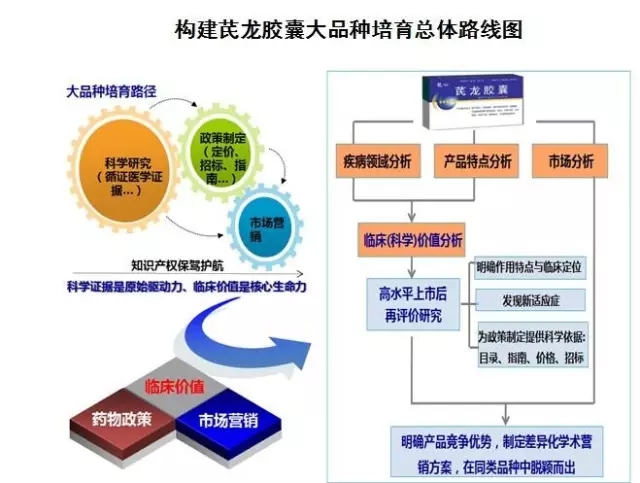
構建芪龍膠囊大品種培育總體路線圖
中藥上市后再評價是以需求為驅動,是逐步深入的過程,也是相關法規逐漸健全的過程。隨著中藥上市后再評價研究的發展,其影響力將進一步增強,必將深入我國的醫藥衛生體系,提供科學客觀的證據,發揮更加重要的作用。(米內網 單文賢報道)
四川省醫藥保化品質量管理協會組織召開
2025版《中國藥典》將于2025年10月..關于舉辦四川省藥品生產企業擬新任質量
各相關企業: 新修訂的《中華人..四川省醫藥保化品質量管理協會召開第七
四川省醫藥保化品質量管理協會第七..“兩新聯萬家,黨建助振興”甘孜行活動
為深入貫徹落實省委兩新工委、省市..學習傳達中央八項規定精神專題會議
2025年4月22日,協會黨支部組織召..關于收取2025年度會費的通知
各會員單位: 在過去的一年里,..四川省應對新型冠狀病毒肺炎疫情應急指
四川省應對新型冠狀病毒肺炎疫情應..四川省應對新型冠狀病毒肺炎疫情應急指
四川省應對新型冠狀病毒肺炎疫情應..