本期看點
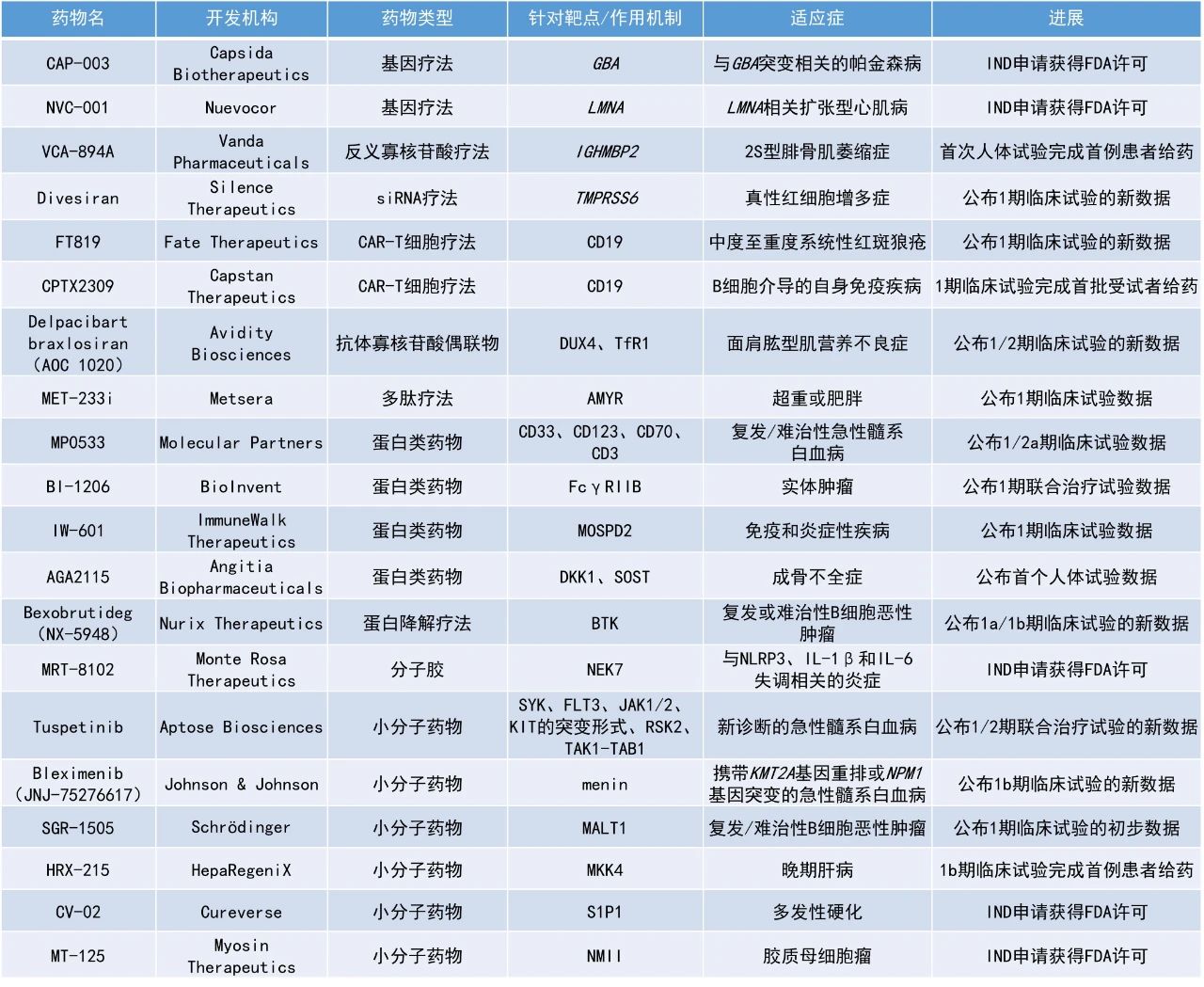
Bleximenib(JNJ-75276617):公布1b期臨床試驗的新數據
強生公司公布了其在研藥物bleximenib的1b期臨床試驗的積極數據。Bleximenib是一種口服menin抑制劑,通過阻斷menin與KMT2A融合蛋白之間的致癌相互作用,抑制攜帶KMT2A基因重排或NPM1基因突變的白血病細胞生長。該研究評估了bleximenib聯用VEN+AZA在復發/難治性(R/R)AML和新確診但不適合強化化療的AML患者中的安全性和有效性。
該研究共納入125名患者,其中52例攜帶KMT2A重排,73例攜帶NPM1突變。在推薦的2期劑量(RP2D)下,R/R AML患者的ORR為82%,cCR率為59%。新確診但不適合強化化療的AML患者的ORR為90%,cCR率為75%。安全性方面,數據顯示分化綜合征的發生率低,且無QTc間期延長的心臟安全信號。
Bexobrutideg(NX-5948):公布1a/1b期臨床試驗的新數據
Nurix Therapeutics公司公布了其布BTK降解劑bexobrutideg單藥治療復發/難治性CLL和WM患者的1a/1b期臨床試驗的新數據。Bexobrutideg是一種口服、可穿越血腦屏障的小分子BTK蛋白降解劑。
截至2025年3月12日,中位隨訪時間為9.0個月,大多數患者仍在接受治療。在療效可評估的47名CLL患者中,客觀緩解率為80.9%,首次緩解的中位時間為1.9個月。許多患者在更長的時間內經歷了緩解加深,多次從病情穩定轉變為部分緩解(PR),一名接受治療兩年多的患者經歷了完全緩解。中位緩解持續時間尚未達到,有18名患者接受了一年多的治療。在所有CLL患者群體中觀察到緩解,無論既往治療、基線突變或中樞神經系統(CNS)受累如何。
在療效可評估的19名WM患者中,客觀緩解率為84.2%,包括2例非常好的部分緩解(VGPR)、11例PR和3例輕微緩解(MR)患者,3名患者獲得疾病穩定(SD)。無論基線時MYD88突變和CXCR4突變的情況如何,患者均觀察到緩解。此外,從4周的第一次評估開始就觀察到關鍵療效指標IgM水平的穩步下降,隨后繼續加深,3例患者的IgM水平降低超過90%。安全性方面,bexobrutideg耐受性良好,在較長的研究持續時間或更高的劑量下未觀察到新的安全信號。
Tuspetinib:公布1/2期聯合治療試驗的新數據
Aptose Biosciences公司公布了其針對新確診的AML患者開展的1/2期TUSCANY試驗的新數據。這些患者接受了不同劑量的tuspabetinib聯用標準劑量的venetoclax和azacitidine(TUS+VEN+AZA三聯療法)。該三聯療法正在被開作發為一種安全且不依賴于特定突變的一線治療方案,用于治療那些無法接受誘導化療的新確診AML患者,這些患者具有多樣的突變。
此次公布的結果顯示,攜帶不同突變(包括TP53突變/復雜核型、FLT3野生型)的AML患者安全地達到了CR和最小殘留病(MRD)陰性。40毫克劑量組(n=4)中有3名患者達到CR且MRD狀態為陰性。80毫克劑量組(n=3)中所有3名患者均達到了CR和伴有血液學不完全恢復的完全緩解(CRi)。120毫克劑量組(n=3)的患者仍在接受治療。安全性方面,該三聯療法的安全性良好,無治療相關死亡,迄今為止接受治療的所有10名患者均存活。
MP0533:公布1/2a期臨床試驗數據
Molecular Partners公司公布了其四特異性T細胞接合器MP0533用于治療R/R AML患者的1/2a期臨床試驗的最新積極數據。MP0533是一種新型多特異性蛋白分子,可同時靶向CD33、CD123、CD70和CD3四個靶點。
截至2025年4月14日的數據,隊列8中8名可評估的R/R AML患者中,有3人(超過30%)在第一個治療周期后達到臨床緩解,其中包括1例CR和2例伴有部分血液學恢復的完全緩解(CRh)。兩名患者的緩解持續時間超過3個月,一名患者仍在接受治療,緩解已維持超過6個月。安全性方面,MP0533在所有隊列中均顯示出可接受的安全性特征。
SGR-1505:公布1期臨床試驗的初步數據
Schrödinger公司宣布其候選藥物SGR-1505在針對復發/難治性B細胞惡性腫瘤患者的1期臨床試驗中展現出積極的初步數據。SGR-1505是一種口服MALT1抑制劑,靶向NF-κB信號通路中的關鍵節點MALT1,旨在阻斷癌細胞的存活與增殖。在臨床前研究中,觀察到SGR-1505具有高效性和選擇性,并且在臨床前模型中作為單一療法以及與BTK抑制劑和BCL-2抑制劑聯用均顯示出抗腫瘤活性。
截至2025年5月13日,49名患者進行了安全性評估,SGR-1505整體安全且耐受性良好,未出現劑量限制毒性或因治療伴發不良事件(TEAE)導致的死亡,常見不良事件包括皮疹和疲勞。45名療效可評估的患者中,ORR為22%,并在多個B細胞腫瘤類型中觀察到緩解,包括CLL/小淋巴細胞白血病(SLL)、WM和邊緣區淋巴瘤(MZL)。值得注意的是,一些曾接受過BTK和BCL-2抑制劑治療失敗的患者也出現了緩解。目前,該研究正擴展至侵襲性淋巴瘤患者,并觀察到1名患者達到PR。
HRX-215:1b期臨床試驗完成首例患者給藥
HepaRegeniX公司宣布其候選藥物HRX-215的1b期臨床試驗已完成首例患者給藥。該試驗旨在評估HRX-215在因結直腸癌肝轉移而接受部分肝切除術的患者中的安全性和有效性。HRX-215是一種口服的小分子抑制劑,靶向肝臟再生過程中的關鍵調節因子絲裂原活化蛋白激酶激酶4(MKK4)。通過選擇性地抑制MKK4,HRX-215已在臨床前模型中被證明可以穩定和保護肝細胞,并加速和增強肝臟再生過程,即使是在受損或患病的肝臟中也同樣有效。
四川省醫藥保化品質量管理協會組織召開
2025版《中國藥典》將于2025年10月..關于舉辦四川省藥品生產企業擬新任質量
各相關企業: 新修訂的《中華人..四川省醫藥保化品質量管理協會召開第七
四川省醫藥保化品質量管理協會第七..“兩新聯萬家,黨建助振興”甘孜行活動
為深入貫徹落實省委兩新工委、省市..學習傳達中央八項規定精神專題會議
2025年4月22日,協會黨支部組織召..關于收取2025年度會費的通知
各會員單位: 在過去的一年里,..四川省應對新型冠狀病毒肺炎疫情應急指
四川省應對新型冠狀病毒肺炎疫情應..四川省應對新型冠狀病毒肺炎疫情應急指
四川省應對新型冠狀病毒肺炎疫情應..