本期看點
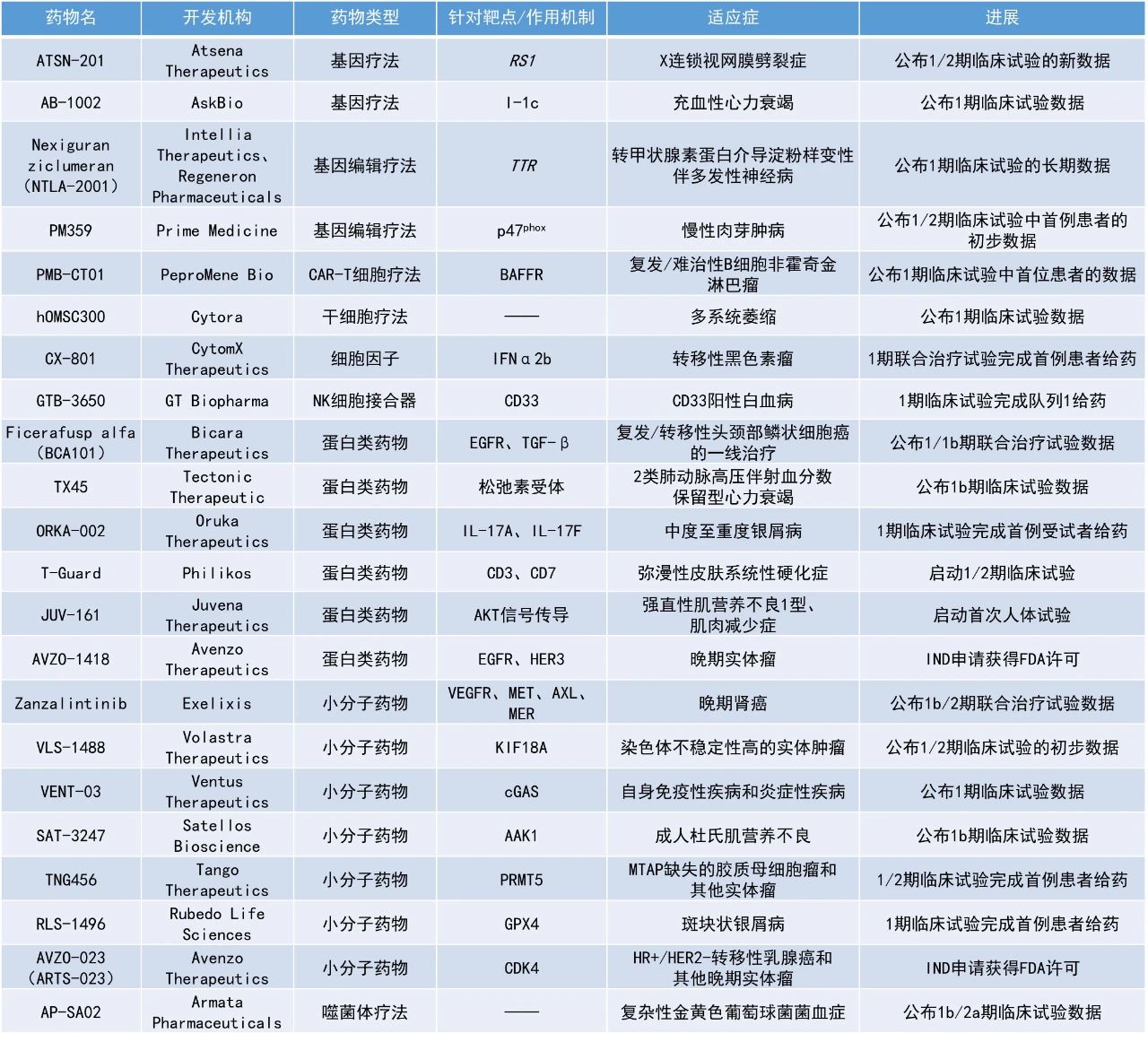
Zanzalintinib:公布1b/2期聯合治療試驗數據
Exelixis公司公布了其1b/2期臨床試驗STELLAR-002的積極結果,該研究旨在評估zanzalintinib聯合免疫檢查點抑制劑用于初治晚期透明細胞腎細胞癌患者的治療效果。Zanzalintinib是一種第三代口服酪氨酸激酶抑制劑,靶向VEGFR、MET、AXL和MER等與腫瘤發展、轉移及耐藥相關的關鍵通路。此次公布的結果顯示,在zanzalintinib聯合納武利尤單抗治療組的中位隨訪時間為20.1個月時,ORR達63%,DCR為90%,中位無進展生存期(PFS)為18.5個月。
Ficerafusp alfa(BCA101):公布1/1b期聯合治療試驗數據
Bicara Therapeutics公司公布了其候選雙功能抗體ficerafusp alfa聯合帕博利珠單抗一線治療復發/轉移性頭頸鱗狀細胞癌患者的1/1b期臨床試驗的新中期數據。Ficerafusp alfa是一種潛在“first-in-class”的雙功能抗體,包括一個靶向EGFR的單克隆抗體和一個能夠結合人類轉化生長因子β(TGF-β)的結構域。通過這種靶向機制,ficerafusp alfa旨在逆轉由TGF-β信號傳導驅動的纖維化和免疫排除型腫瘤微環境,從而實現腫瘤穿透,促使深度且持久的治療應答。
截至2024年12月16日的數據,在PD-L1綜合陽性評分(CPS)≥1、HPV陰性且療效可評估的28例患者中,ORR達到了64%,完全緩解(CR)率為21%,中位PFS為9.8個月,中位總生存期(OS)已超過20個月。來自成對腫瘤活檢的數據表明,治療后磷酸化SMAD2表達顯著下調,支持該藥物靶向TGF-β通路的有效抑制作用。此外,安全性數據顯示其副作用情況符合預期,并未發現新的安全問題。
SAT-3247:公布1b期臨床試驗數據
Satellos Bioscience公司公布了一項針對成年DMD男性患者的1b期臨床試驗的積極數據。該研究中使用的SAT-3247是一種口服小分子藥物,正在開發作為一種新型治療方法,用于在DMD和其他退行性或損傷情況下丟失骨骼肌的再生。該研究治療了5名20至27歲的成年男性DMD患者。
此次公布的結果顯示,SAT-3247具有良好的安全性和耐受性。在同時使用類固醇的DMD患者中,其藥代動力學(PK)表現與預期一致。觀察到患者有握力顯著改善的趨勢,平均握力從約2 kg增加至約4 kg。研究結束后,受試者可選擇進入11個月的長期隨訪。基于當前結果,Satellos計劃推進該藥物進入安慰劑對照的2期臨床試驗,以進一步評估其療效與安全性。
VLS-1488:公布1/2期臨床試驗的初步數據
Volastra Therapeutics公司公布了其在研口服KIF18A抑制劑VLS-1488的1/2期臨床試驗的初步結果。VLS-1488是一種新型口服小分子KIF18A抑制劑。KIF18A是一種驅動蛋白,在癌細胞分裂過程中發揮關鍵作用,并且是染色體不穩定型癌癥中的合成致死靶點。2024年10月,該藥物被美國FDA授予快速通道資格,用于治療鉑類耐藥的高級別漿液性卵巢癌患者。
截至2025年1月10日的數據,在劑量遞增試驗中共納入52名晚期實體瘤患者。在20名患有晚期高級別漿液性卵巢癌的患者中,大多數為鉑類耐藥且經過大量前期治療,平均接受過5線治療。在療效可評估的17名患者中,有7人出現了腫瘤縮小,其中包括3例根據RECIST標準確認的部分緩解(PR),另有5名患者仍在繼續接受治療。安全性方面,未發現劑量限制性毒性,僅出現少數3級治療相關不良事件(TRAE),無高于3級的嚴重TRAE。
RLS-1496:1期臨床試驗完成首例患者給藥
Rubedo Life Sciences公司宣布其候選藥物RLS-1496在一項針對輕度至中度和穩定型斑塊狀銀屑病患者的1期臨床試驗中完成了首例患者給藥。RLS-1496是一種潛在“first-in-class”的谷胱甘肽過氧化物酶(GPX4)調節劑,專門靶向導致慢性退行性疾病和衰老相關病癥的病理衰老“僵尸”細胞。GPX4是一種關鍵抗氧化酶,保護細胞免受自由基損傷,而GPX4缺乏則與特定類型的細胞死亡(如鐵死亡)有關。通過選擇性地促進這些敏感細胞的死亡,RLS-1496旨在清除致病細胞,同時支持健康細胞正常功能。新聞稿指出,RLS-1496是首個進入人體臨床試驗的GPX4調節劑。根據該研究的結果,未來可能將試驗擴展至其他炎癥性皮膚病和自身免疫疾病,包括但不限于特應性皮炎、白癜風、玫瑰痤瘡、斑禿和硬皮病。
JUV-161:啟動首次人體試驗
Juvena Therapeutics公司宣布啟動其候選藥物JUV-161的首次人體臨床試驗。JUV-161是一種潛在“first-in-class”的融合蛋白,通過促肌生成、調節胰島素抵抗以及抗炎特性來增強肌肉再生。JUV-161被稱為潛在的“肌肉胰島素”,在多個臨床前疾病模型中表現出獨特的能力,包括恢復肌纖維形成、對抗肌肉萎縮、增強肌肉力量和耐力,并改善肌肉代謝,這些模型涵蓋了從肌營養不良癥到因衰老、肥胖、糖尿病和炎癥引起的肌肉減少癥等疾病。這種長效的研究性生物制品通過激活并恢復AKT信號通路發揮作用,該通路調控細胞存活、生長和代謝,在肌肉萎縮性疾病及自然衰老過程中常常出現失調。JUV-161由Juvena自主研發的AI藥物發現與開發平臺JuvNET識別確定,其主要作用機制來源于一種經過工程改造的人類類胰島素生長因子2(IGF2)蛋白,適用于皮下注射。
四川省醫藥保化品質量管理協會組織召開
2025版《中國藥典》將于2025年10月..關于舉辦四川省藥品生產企業擬新任質量
各相關企業: 新修訂的《中華人..四川省醫藥保化品質量管理協會召開第七
四川省醫藥保化品質量管理協會第七..“兩新聯萬家,黨建助振興”甘孜行活動
為深入貫徹落實省委兩新工委、省市..學習傳達中央八項規定精神專題會議
2025年4月22日,協會黨支部組織召..關于收取2025年度會費的通知
各會員單位: 在過去的一年里,..四川省應對新型冠狀病毒肺炎疫情應急指
四川省應對新型冠狀病毒肺炎疫情應..四川省應對新型冠狀病毒肺炎疫情應急指
四川省應對新型冠狀病毒肺炎疫情應..