5月8日,歐洲藥品管理局(EMA)GMP/GDP檢查工作組發布了“關于修訂第四部分先進療法產品GMP指南的概念性文件”,文件指出,ATMP指南修訂將與2023年8月生效的無菌附錄保持一致,同時保持ATMP生產的靈活方法。該文件征求意見的截止時間是2025年7月8日。
指南更新將涵蓋哪些變化
歐盟的ATMP GMP指南發布于2017年11月,那時歐盟無菌附錄仍在修訂中,后于2022年8月最終定稿,因此無菌附錄修訂的相關概念和要求均未體現在ATMP指南中,如質量風險管理(QRM)、藥品質量體系(PQS)、污染控制策略(CCS)等。
ATMP指南將澄清以下內容:
新技術進步:將進一步澄清潔凈室及密閉系統(隔離器和RABS)的確認、控制和管理要求,同時考慮到個性化批次有大量手動操作,指南對使用生物安全柜仍持開放態度;指南將包括當前指南未涵蓋的新技術,如自動化先進技術、(密閉)一次性使用技術、快速微生物檢測方法等;
人源起始物料的定義:2024年7月17日,歐盟更新了關于擬用于人體的人源物質的質量和安全標準的法規(Regulation 2024/1938),本次修訂將更新人源起始物料參考的法規依據和定義;
指南修訂將僅關注和無菌附錄相關的無菌生產章節,而不會更新該范圍外的主題/章節。
指南修訂時間表
指南修訂后續的時間安排如下:
2025年5月 – 概念性文件公開征求意見
2025年7月 – 征求意見截止
2026年9月 – 發布指南修訂草案
2026年12月 – 征求意見截止
2027年3月 – GMDP工作組采納
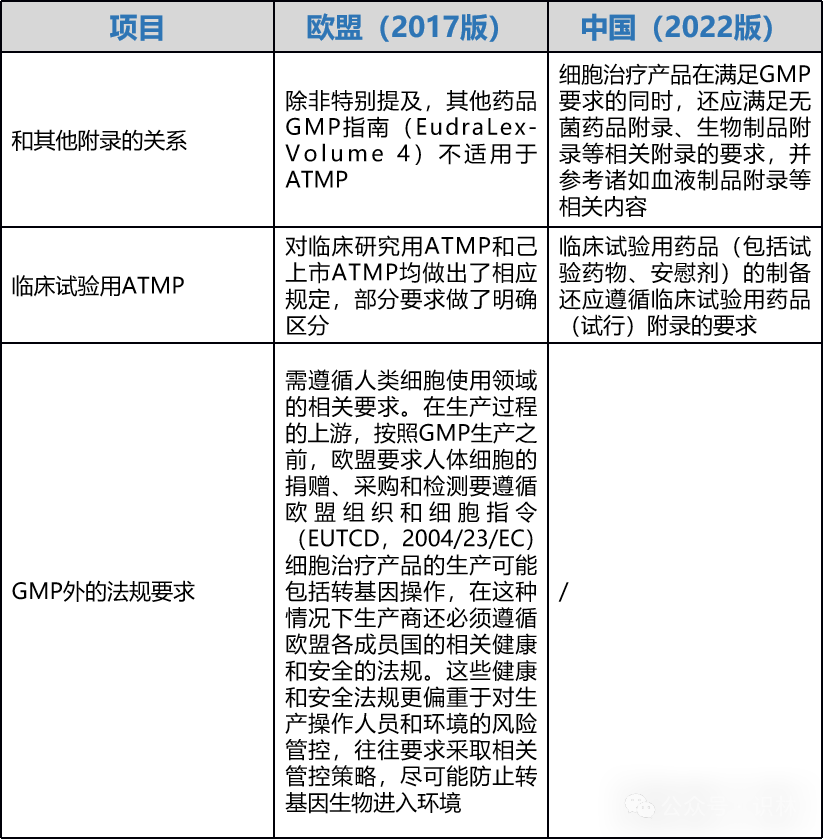
指南當前版本和中國指南應用的差異
我國于2019年11月首次發布了《藥品生產質量管理規范-細胞治療產品附錄(征求意見稿)》,在2022年1月再次更新征求意見,并最終由CFDI于2022年10月發布《細胞治療產品生產質量管理指南(試行)》。二者均為針對細胞治療產品等先進療法產品的指南,以下差異值得關注:
四川省醫藥保化品質量管理協會組織召開
2025版《中國藥典》將于2025年10月..關于舉辦四川省藥品生產企業擬新任質量
各相關企業: 新修訂的《中華人..四川省醫藥保化品質量管理協會召開第七
四川省醫藥保化品質量管理協會第七..“兩新聯萬家,黨建助振興”甘孜行活動
為深入貫徹落實省委兩新工委、省市..學習傳達中央八項規定精神專題會議
2025年4月22日,協會黨支部組織召..關于收取2025年度會費的通知
各會員單位: 在過去的一年里,..四川省應對新型冠狀病毒肺炎疫情應急指
四川省應對新型冠狀病毒肺炎疫情應..四川省應對新型冠狀病毒肺炎疫情應急指
四川省應對新型冠狀病毒肺炎疫情應..