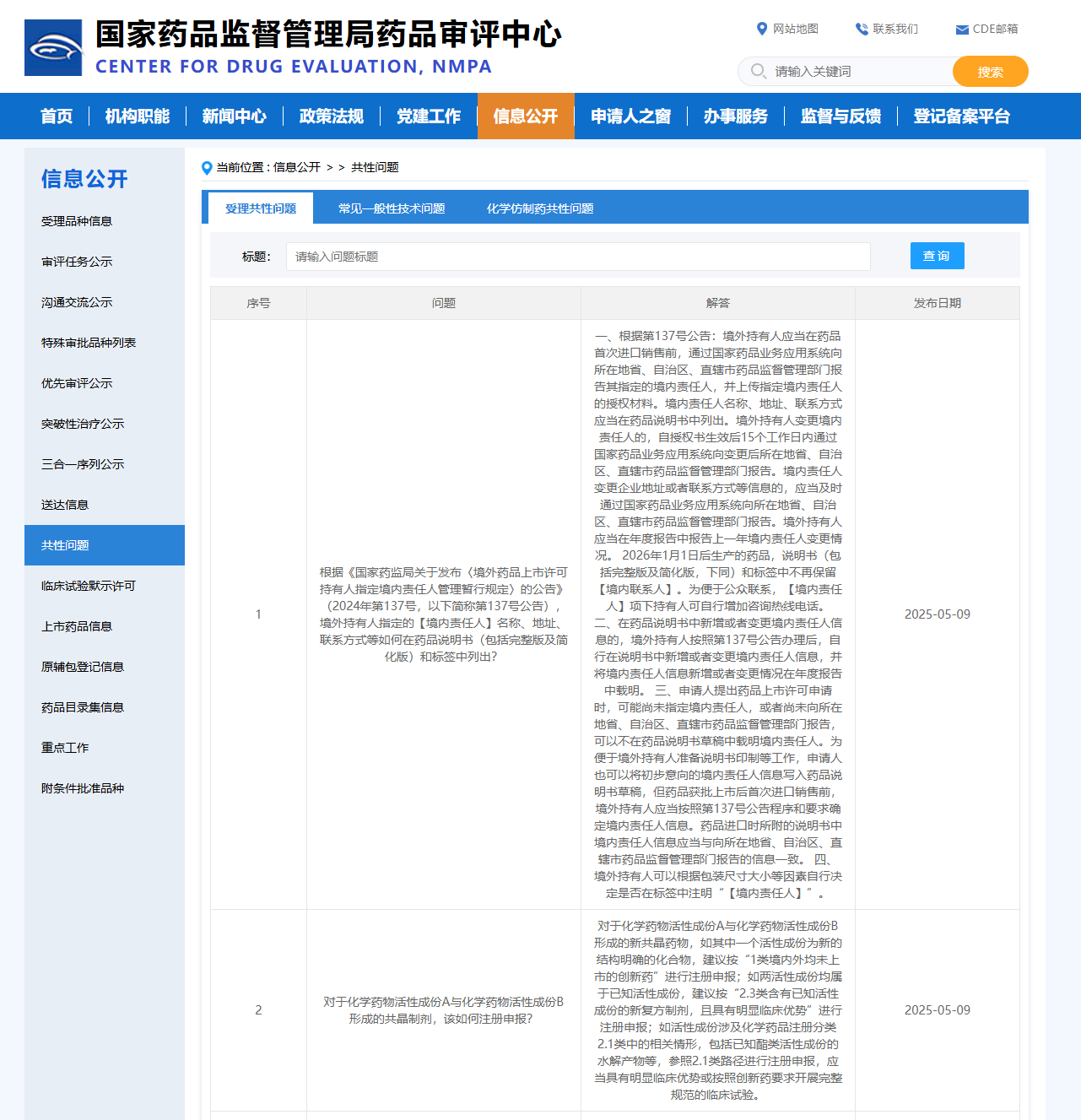
Q1:根據《國家藥監局關于發布〈境外藥品上市許可持有人指定境內責任人管理暫行規定〉的公告》(2024年第137號,以下簡稱第137號公告),境外持有人指定的【境內責任人】名稱、地址、聯系方式等如何在藥品說明書(包括完整版及簡化版)和標簽中列出?
A1:一、根據第137號公告:境外持有人應當在藥品首次進口銷售前,通過國家藥品業務應用系統向所在地省、自治區、直轄市藥品監督管理部門報告其指定的境內責任人,并上傳指定境內責任人的授權材料。境內責任人名稱、地址、聯系方式應當在藥品說明書中列出。境外持有人變更境內責任人的,自授權書生效后15個工作日內通過國家藥品業務應用系統向變更后所在地省、自治區、直轄市藥品監督管理部門報告。境內責任人變更企業地址或者聯系方式等信息的,應當及時通過國家藥品業務應用系統向所在地省、自治區、直轄市藥品監督管理部門報告。境外持有人應當在年度報告中報告上一年境內責任人變更情況。2026年1月1日后生產的藥品,說明書(包括完整版及簡化版,下同)和標簽中不再保留【境內聯系人】。為便于公眾聯系,【境內責任人】項下持有人可自行增加咨詢熱線電話。
二、在藥品說明書中新增或者變更境內責任人信息的,境外持有人按照第137號公告辦理后,自行在說明書中新增或者變更境內責任人信息,并將境內責任人信息新增或者變更情況在年度報告中載明。
三、申請人提出藥品上市許可申請時,可能尚未指定境內責任人,或者尚未向所在地省、自治區、直轄市藥品監督管理部門報告,可以不在藥品說明書草稿中載明境內責任人。為便于境外持有人準備說明書印制等工作,申請人也可以將初步意向的境內責任人信息寫入藥品說明書草稿,但藥品獲批上市后首次進口銷售前,境外持有人應當按照第137號公告程序和要求確定境內責任人信息。藥品進口時所附的說明書中境內責任人信息應當與向所在地省、自治區、直轄市藥品監督管理部門報告的信息一致。
四、境外持有人可以根據包裝尺寸大小等因素自行決定是否在標簽中注明“【境內責任人】”。
Q2:對于化學藥物活性成份A與化學藥物活性成份B形成的共晶制劑,該如何注冊申報?
A2:對于化學藥物活性成份A與化學藥物活性成份B形成的新共晶藥物,如其中一個活性成份為新的結構明確的化合物,建議按“1類境內外均未上市的創新藥”進行注冊申報;如兩活性成份均屬于已知活性成份,建議按“2.3類含有已知活性成份的新復方制劑,且具有明顯臨床優勢”進行注冊申報;如活性成份涉及化學藥品注冊分類2.1類中的相關情形,包括已知酯類活性成份的水解產物等,參照2.1類路徑進行注冊申報,應當具有明顯臨床優勢或按照創新藥要求開展完整規范的臨床試驗。
四川省醫藥保化品質量管理協會組織召開
2025版《中國藥典》將于2025年10月..關于舉辦四川省藥品生產企業擬新任質量
各相關企業: 新修訂的《中華人..四川省醫藥保化品質量管理協會召開第七
四川省醫藥保化品質量管理協會第七..“兩新聯萬家,黨建助振興”甘孜行活動
為深入貫徹落實省委兩新工委、省市..學習傳達中央八項規定精神專題會議
2025年4月22日,協會黨支部組織召..關于收取2025年度會費的通知
各會員單位: 在過去的一年里,..四川省應對新型冠狀病毒肺炎疫情應急指
四川省應對新型冠狀病毒肺炎疫情應..四川省應對新型冠狀病毒肺炎疫情應急指
四川省應對新型冠狀病毒肺炎疫情應..