5 月 9 日,NMPA 官網顯示,翰森制藥「甲磺酸阿美替尼片」(阿美樂®)獲批一項新適應癥(受理號:CXHS2400060),用于具有表皮生長因素受體(EGFR)外顯子 19 缺失或外顯子 21(L858R)置換突變陽性的非小細胞肺癌(NSCLC)成人患者腫瘤切除術后的輔助治療。


阿美替尼由翰森制藥研發,該藥創新性地引入環丙基結構,具有良好的脂溶性和穩定性,能更好地透過血腦屏障,且不良反應發生率低。阿美替尼是國產首款三代 EGFR-TKI,早在 2020 年 3 月就已經獲批上市,同年通過談判進入醫保目錄。
翰森針對阿美替尼進行了廣泛而深入的適應癥布局,陸續獲批了二線適應癥、一線適應癥、維持/鞏固治療,現今又獲批了輔助療法適應癥。
在已獲批適應癥之外,翰森還探索了阿美替尼聯用化療(培美曲塞和鉑類)一線治療 NSCLC,該項適應癥也已經在 2024 年 11 月報上市(CXHS2400127),Insight 數據庫預計將于今年下半年獲批。
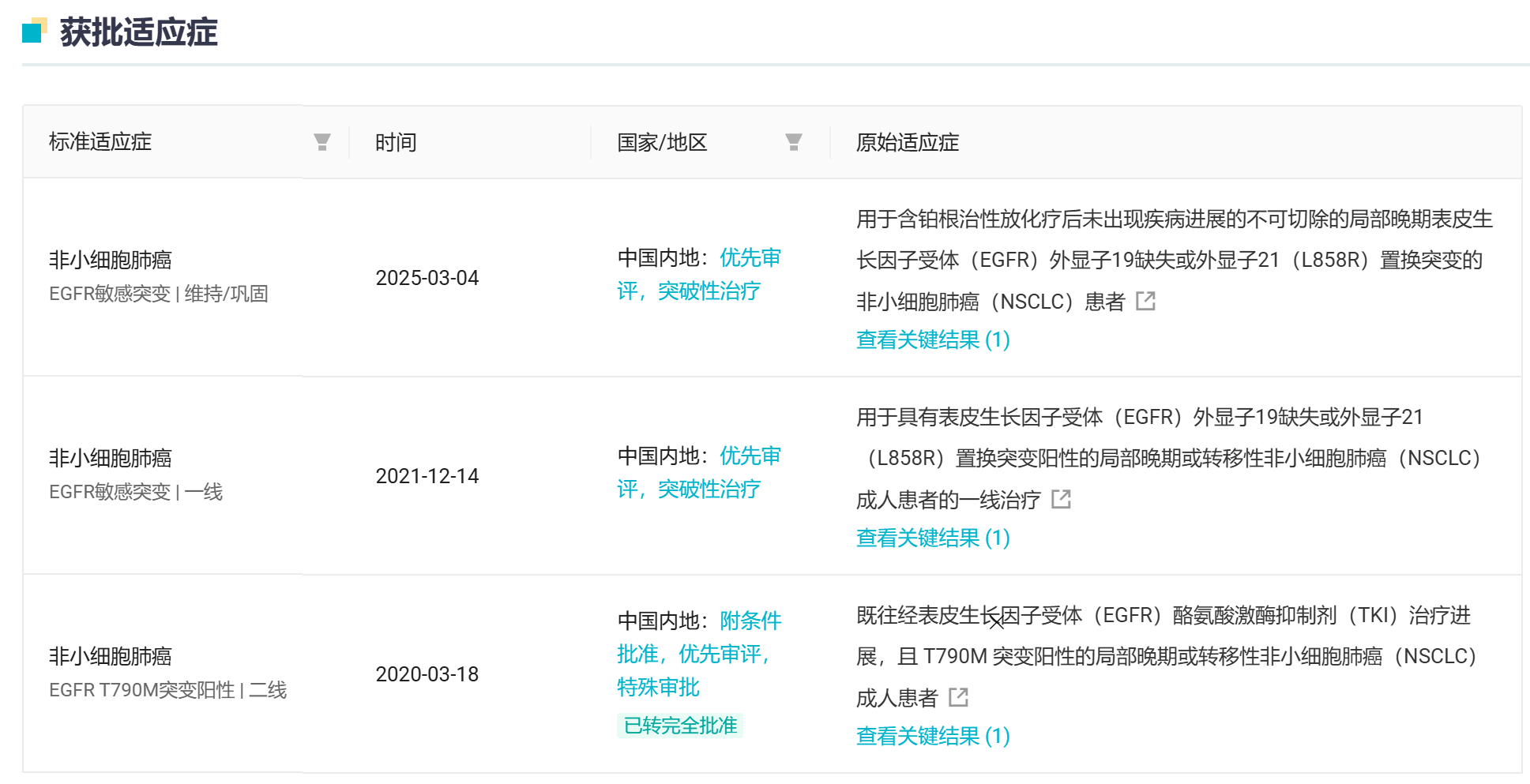
阿美替尼此前已上市適應癥
本次上市批準是基于 III 期臨床試驗 HS-10296-302 研究(NCT04687241)的積極數據。這是一項隨機、對照、雙盲、多中心 III 期臨床研究,旨在評估甲磺酸阿美替尼對比安慰劑用于表皮生長因子受體敏感突變陽性 II-IIIB 期 NSCLC 輔助治療的有效性和安全性。
結果顯示,阿美替尼組未達到 BICR 評估的 mDFS,而安慰劑組為19.4個月(HR 為 0.166,p<0.0001)。阿美替尼組 2 年 DFS 率為 88.2%,安慰劑組為 40.6%。研究者評估的 DFS 與 BICR 評估結果一致。數據截止時,OS 數據尚不成熟(奧莫替尼和安慰劑 OS 成熟度:2.8% vs. 3.8%)。
在安全性方面,阿美替尼和安慰劑組導致劑量中斷、劑量減少及停藥的不良事件發生率分別為 12.3% vs. 17.8%、9.4% vs. 1.9% 和 0.9% vs. 0。未觀察到新的安全風險。
四川省醫藥保化品質量管理協會組織召開
2025版《中國藥典》將于2025年10月..關于舉辦四川省藥品生產企業擬新任質量
各相關企業: 新修訂的《中華人..四川省醫藥保化品質量管理協會召開第七
四川省醫藥保化品質量管理協會第七..“兩新聯萬家,黨建助振興”甘孜行活動
為深入貫徹落實省委兩新工委、省市..學習傳達中央八項規定精神專題會議
2025年4月22日,協會黨支部組織召..關于收取2025年度會費的通知
各會員單位: 在過去的一年里,..四川省應對新型冠狀病毒肺炎疫情應急指
四川省應對新型冠狀病毒肺炎疫情應..四川省應對新型冠狀病毒肺炎疫情應急指
四川省應對新型冠狀病毒肺炎疫情應..