4月19日,中國國家藥監局藥品審評中心(CDE)官網最新公示,渤健(Biogen)申報的諾西那生鈉注射液兩項新的NDA上市申請獲得受理。諾西那生鈉(nusinersen)是一款治療脊髓性肌萎縮癥(SMA)的疾病修正治療藥物。該產品此前已經于2019年2月在中國獲批治療5q SMA。5q SMA是該疾病最常見的形式,約占所有SMA病例的95%。
2024年9月,渤健宣布高劑量諾西那生鈉臨床研究取得積極主要結果,治療SMA獲益顯著。與已獲批的12毫克劑量方案相比,高劑量治療方案在臨床療效的關鍵指標上表現出積極趨勢,渤健此前新聞稿表示,計劃提交該劑量療法的上市申請。
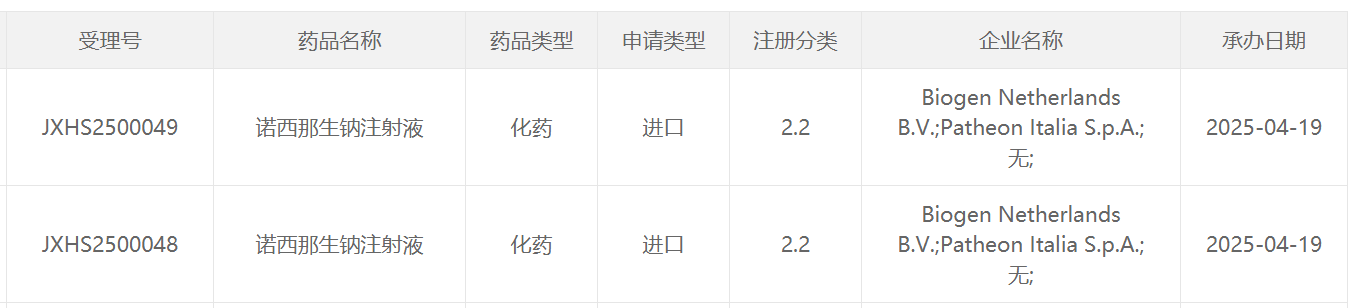
截圖來源:CDE官網
SMA是由于運動神經元存活基因1(SMN1)突變導致SMN蛋白功能缺陷所致的遺傳性神經肌肉病,以肌無力和肌萎縮為主要臨床特征。SMA患者臨床表現差異性很大,發病年齡可以從出生前即開始(宮內發病),也可在成年后發病。其中最嚴重的SMA I型患者在宮內就表現為胎動減少,出生時為松軟兒,發病時表現為全身松軟無力,嚴重肌張力低下,最終失去所有自主運動能力,鼻飼喂養、反復呼吸道感染而致呼吸衰竭。
諾西那生鈉是一種反義寡核苷酸(ASO),通過鞘內注射直接作用于脊髓運動神經元,可增加完整長度SMN蛋白的產生,從而治療因SMN1基因(位于染色體5q)突變或缺失造成的SMN蛋白缺乏,進而引起的SMA。2016年底,該藥獲得美國FDA批準上市脊髓性肌萎縮癥,成為首款治療SMA的療法。
2024年9月,渤健公布了2/3期DEVOTE研究關鍵隊列(B部分)的積極主要數據。這項研究評估了高劑量諾西那生鈉治療方案對已表現出SMA癥狀的初治嬰兒患者的安全性和療效。相較已獲批的諾西那生鈉治療方案,該在研高劑量治療方案的初期給藥速度更快(兩次50毫克,間隔14天),維持劑量更高(每4個月28毫克)。
這項研究在6個月時達到主要終點。相較ENDEAR研究中的預設匹配假手術對照組(初治),接受高劑量方案的嬰兒在運動功能方面展現出具有統計學意義的顯著改善。
具體而言,DEVOTE研究分為三個部分,共招募了145名不同年齡階段和不同類型的SMA患者。關鍵隊列B部分由初治SMA嬰兒患者(n=75)組成,他們以2:1的比例隨機分配接受在研高劑量諾西那生鈉治療方案和已獲批的12毫克治療方案(包括四次初始劑量和每四個月一次的維持劑量)。B部分的主要終點是治療6個月時費城兒童醫院嬰兒神經肌肉疾病測試(CHOP-INTEND)結果相對于基線的變化,比較對象為接受高劑量諾西那生鈉治療方案的試驗組和3期ENDEAR研究中初治的匹配假手術對照組。ENDEAR是支持諾西那生鈉12毫克注射液獲得批準的兩項關鍵研究之一。
第64天的數據顯示,與已獲批的劑量方案相比,高劑量方案顯著降低了神經絲水平,表明其能更迅速地減緩神經退行性變。在研究的主要終點上,6個月時CHOP-INTEND量表結果相對于基線的變化表明,高劑量試驗組相較匹配假手術對照組取得了具有統計學意義的顯著改善。高劑量治療方案的耐受性總體良好,報告的不良事件與SMA相關癥狀及諾西那生鈉已知的安全性特征基本一致。與12毫克組(72%,18例)相比,高劑量試驗組患者發生嚴重不良事件的比例更低(60%,30例)。
根據中國藥物臨床試驗登記與信息公示平臺,DEVOTE研究在中國的部分也已經完成。渤健還正在開展一項國際多中心(含中國)3期臨床研究,即在既往參加過諾西那生鈉試驗性研究的SMA受試者中給予高劑量諾西那生鈉的長期擴展研究。
四川省醫藥保化品質量管理協會組織召開
2025版《中國藥典》將于2025年10月..關于舉辦四川省藥品生產企業擬新任質量
各相關企業: 新修訂的《中華人..四川省醫藥保化品質量管理協會召開第七
四川省醫藥保化品質量管理協會第七..“兩新聯萬家,黨建助振興”甘孜行活動
為深入貫徹落實省委兩新工委、省市..學習傳達中央八項規定精神專題會議
2025年4月22日,協會黨支部組織召..關于收取2025年度會費的通知
各會員單位: 在過去的一年里,..四川省應對新型冠狀病毒肺炎疫情應急指
四川省應對新型冠狀病毒肺炎疫情應..四川省應對新型冠狀病毒肺炎疫情應急指
四川省應對新型冠狀病毒肺炎疫情應..