根據中國臨床研究進展推測,本次該產品申報上市的適應癥可能為聯合阿扎胞甘一線治療攜帶易感IDH1突變的AML患者。
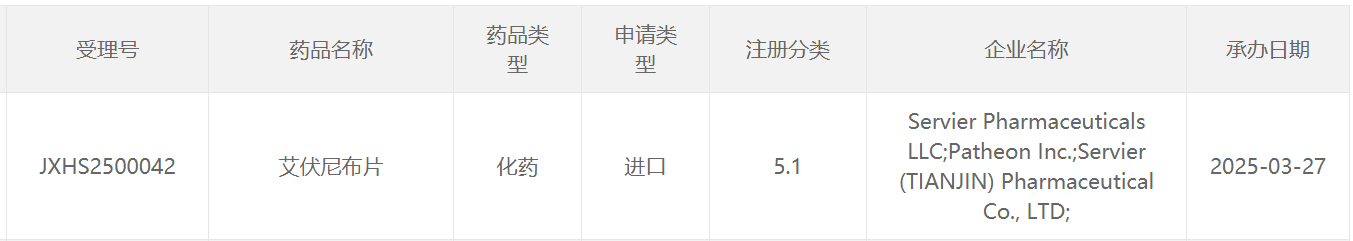 截圖來源:CDE官網
截圖來源:CDE官網
艾伏尼布片是一種針對IDH1突變酶的口服靶向抑制劑。該產品曾獲得美國FDA授予快速通道資格、孤兒藥資格,并于2018年7月首次獲得FDA批準。在中國,該產品于2020年11月被納入《第三批臨床急需境外新藥名單》,于2022年1月通過優(yōu)先審評審批程序附條件獲得中國NMPA批準。2024年8月,該產品還入圍了2024年蓋倫獎候選名單。
在美國,該藥目前已獲批適用于經FDA批準的試驗檢測出的攜帶易感IDH1突變的患者,包括:與阿扎胞苷聯用或單藥治療75歲或以上或有合并癥不能使用強化誘導化療的成人新診斷的AML;單藥治療復發(fā)或難治性AML成人患者;治療復發(fā)或難治性骨髓增生異常綜合征(MDS)成人患者;既往接受過治療的局部晚期或轉移性膽管癌成年患者。在中國,艾伏尼布已獲批準用于治療攜帶易感IDH1突變的成年復發(fā)性或難治性AML患者。
根據中國藥物臨床試驗登記與信息公示平臺官網,研究人員已經在中國開展了一項3期、隨機雙盲、安慰劑對照的多中心研究,針對受試者人群為IDH1突變急性髓性白血病且未經治療的患者,評估與聯合使用阿扎胞苷和安慰劑相比,聯合艾伏尼布片和阿扎胞苷能否顯著延長患者總生存期(OS)。該研究在全球20個國家和地區(qū)開展,目前已經完成患者招募。
針對一線治療攜帶IDH1突變的AML適應癥,艾伏尼布片于2022年獲得FDA批準。這一批準得到全球性3期臨床試驗AGILE數據的支持。這是一項全球3期、多中心、雙盲、隨機、安慰劑對照臨床試驗,研究結果已在《新英格蘭醫(yī)學雜志》上發(fā)表。
試驗結果顯示,與化療相比,艾伏尼布與阿扎胞苷聯用,顯著改善了患者的無事件生存期(EFS)。艾伏尼布與阿扎胞苷聯用,顯示出總生存期(OS)的統計學顯著改善,艾伏尼布組中位OS為24.0個月,是對照組(7.9個月)的3倍。此外,艾伏尼布聯合阿扎胞苷的完全緩解(CR)率為47.2%,而安慰劑聯合阿扎胞苷為14.9%。艾伏尼布聯合阿扎胞苷的完全緩解加完全緩解伴部分血液學恢復的緩解率(CR+CRh)為52.8%,而安慰劑聯合阿扎胞苷組為17.6%。艾伏尼布聯合阿扎胞苷的客觀緩解率(ORR)為62.5%,而安慰劑聯合阿扎胞苷組為18.9%。
除了上述適應癥,施維雅還在評估艾伏尼布片用于其他IDH1突變癌癥的應用潛力。今年1月,施維雅宣布了兩項3期臨床研究進展更新,兩項3期研究分別評估艾伏尼布針對IDH1突變型常規(guī)軟骨肉瘤、特定的IDH1突變型骨髓增生異常綜合征患者的療效和安全性。
四川省醫(yī)藥保化品質量管理協會組織召開
2025版《中國藥典》將于2025年10月..關于舉辦四川省藥品生產企業(yè)擬新任質量
各相關企業(yè): 新修訂的《中華人..四川省醫(yī)藥保化品質量管理協會召開第七
四川省醫(yī)藥保化品質量管理協會第七..“兩新聯萬家,黨建助振興”甘孜行活動
為深入貫徹落實省委兩新工委、省市..學習傳達中央八項規(guī)定精神專題會議
2025年4月22日,協會黨支部組織召..關于收取2025年度會費的通知
各會員單位: 在過去的一年里,..四川省應對新型冠狀病毒肺炎疫情應急指
四川省應對新型冠狀病毒肺炎疫情應..四川省應對新型冠狀病毒肺炎疫情應急指
四川省應對新型冠狀病毒肺炎疫情應..