 圖片來源:CDE官網
圖片來源:CDE官網
肺癌患者中約80%~85%為非小細胞肺癌(NSCLC)。根據文獻數據,中國NSCLC患者中約5.6%呈現間變性淋巴瘤激酶(ALK)基因突變。目前多項研究表明了二代或三代ALK抑制劑的療效,ALK陽性患者治療進入“慢病化”管理模式。但耐藥、疾病復發和中樞神經系統進展、以及各種安全性等問題仍然存在。
REMARK研究是一項開放標簽、隨機、3期臨床研究,納入了既往未經治療的ALK陽性晚期NSCLC患者。患者根據基線ECOG評分(0/1 vs 2)和是否發生CNS轉移進行分層分析,并按1:1比例隨機分為接受復瑞替尼治療(160mg,每日一次)或另一款ROS1酪氨酸激酶抑制劑治療(250mg,每日兩次,以下稱“對照藥”)。研究主要終點為由獨立評審委員會(IRC)評估的無進展生存期(PFS)。
根據復星醫藥此前公布的研究結果,從2020年12月至2022年3月,該研究共招募275例患者,其中139例接受復瑞替尼治療,136例接受對照藥治療。截至2024年3月,中位隨訪時間為16.7個月。研究發現:
復瑞替尼治療組的PFS相較于對照藥治療組具有顯著改善,對照藥治療組的中位PFS為13.93個月,而復瑞替尼治療組尚未達到。
此外,相比于對照藥,復瑞替尼顯著降低CNS進展風險。對照藥治療組中位至CNS進展時間(CNS-TTP)為19.32個月,而復瑞替尼組尚未達到。另外,復瑞替尼有改善總生存期(OS)的趨勢。
同時,研究結果顯示復瑞替尼治療組的客觀應答率(ORR)達到92.8%,相較于對照藥治療組提高12%(P=0.0035);且對于基線腦轉移的患者,復瑞替尼治療組的顱內ORR可達到100%,而對照藥治療組為50%。
安全性方面,復瑞替尼治療組患者3/4級治療相關不良事件(TRAEs)的發生率為37.7%,對照藥治療組為55.6%。復瑞替尼治療后最常見的3/4級TRAEs為高血糖、高血壓和QT間期延長。復瑞替尼治療組未觀察到間質性肺病或視力下降。兩組患者治療后均未報告致死性TRAE。
研究人員認為,該研究結果表明復瑞替尼整體療效良好,相比于對照藥治療可使PFS顯著改善,使CNS進展風險降低,且其安全性可控,治療后未出現新的安全性信號。復瑞替尼的出現有望突破目前ALK陽性NSCLC治療所面臨的臨床困難,為NSCLC患者帶來新的治療選擇。
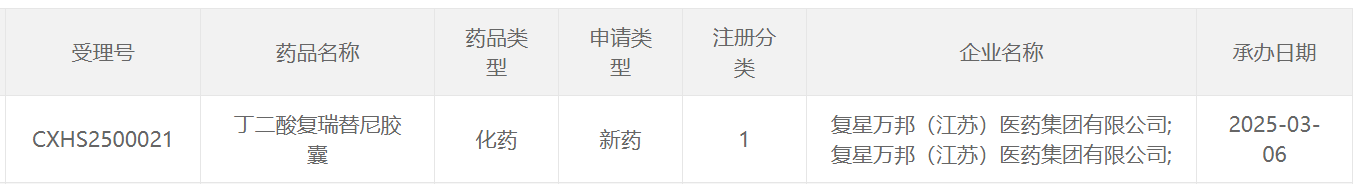
本次復瑞替尼在中國的上市申請獲得受理,意味著該產品距離造福患者再進一步。
四川省醫藥保化品質量管理協會組織召開
2025版《中國藥典》將于2025年10月..關于舉辦四川省藥品生產企業擬新任質量
各相關企業: 新修訂的《中華人..四川省醫藥保化品質量管理協會召開第七
四川省醫藥保化品質量管理協會第七..“兩新聯萬家,黨建助振興”甘孜行活動
為深入貫徹落實省委兩新工委、省市..學習傳達中央八項規定精神專題會議
2025年4月22日,協會黨支部組織召..關于收取2025年度會費的通知
各會員單位: 在過去的一年里,..四川省應對新型冠狀病毒肺炎疫情應急指
四川省應對新型冠狀病毒肺炎疫情應..四川省應對新型冠狀病毒肺炎疫情應急指
四川省應對新型冠狀病毒肺炎疫情應..