本期看點
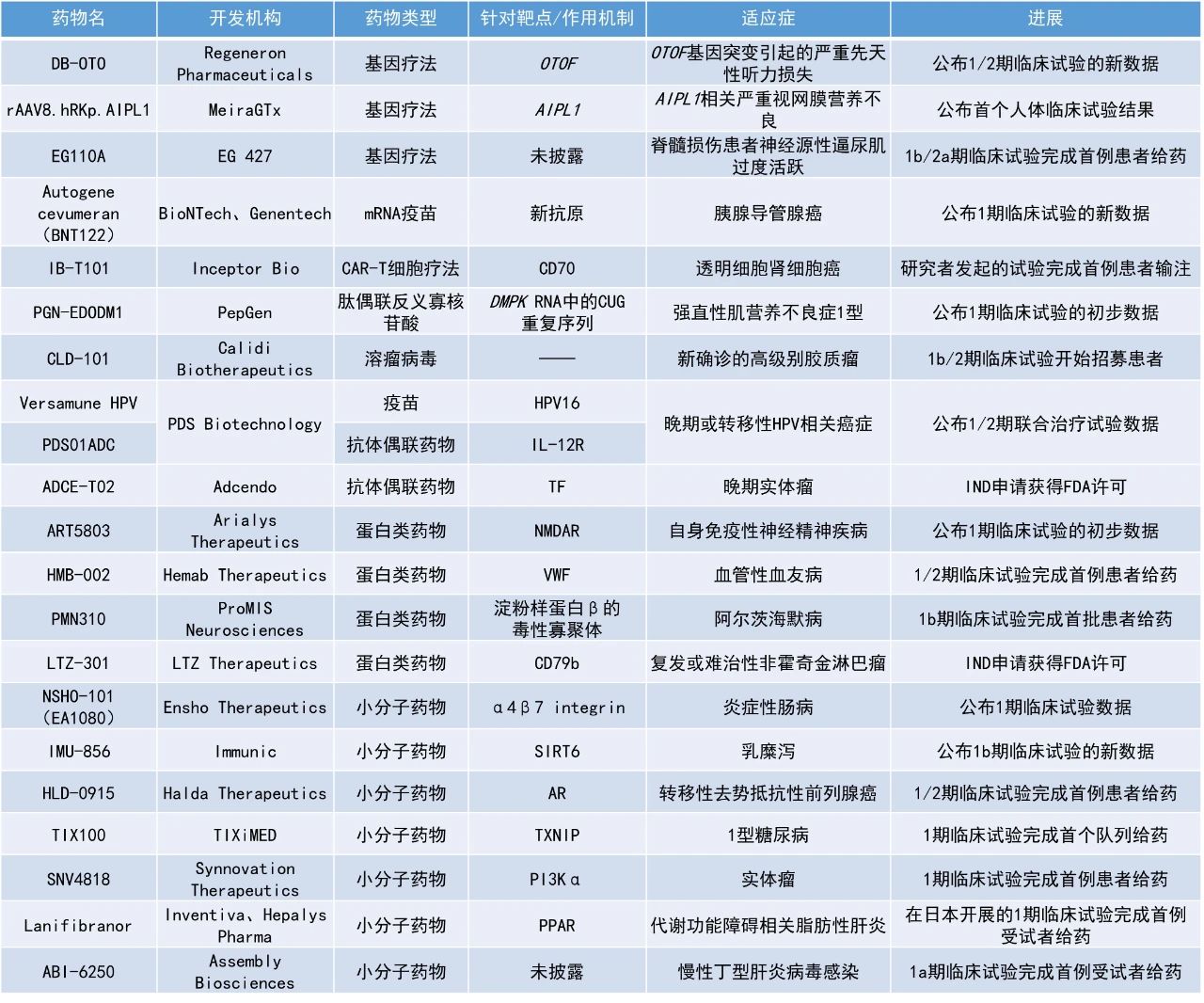
Autogene cevumeran(BNT122):公布1期臨床試驗的新數據
在這項1期臨床試驗中,研究人員給19名接受過手術治療的PDAC患者使用了抗PD-L1抗體atezolizumab的治療,其中16人接受了隨后的autogene cevumeran治療。在這16名患者中,有15人此后還接受了化療。在2023年發表的研究顯示,16名接受癌癥疫苗治療的患者中有8人(50%)產生了T細胞反應,被認為是這種癌癥疫苗治療的應答患者。近日發布的論文公布了這些患者的3年隨訪數據,結果表明,autogene cevumeran能夠持續降低患者的疾病復發風險。在中位隨訪時間為3.2年時,對該疫苗產生應答的PDAC患者的疾病復發風險與未產生應答的患者相比,降低了86%。兩組患者的中位總生存期(OS)均尚未達到。
DB-OTO:公布1/2期臨床試驗的新數據
再生元(Regeneron Pharmaceuticals)公布了其用于治療遺傳性耳聾的在研基因療法DB-OTO的1/2期臨床試驗的新數據。DB-OTO是一種在研細胞選擇性腺相關病毒(AAV)基因療法,旨在通過AAV載體將OTOF基因的健康拷貝傳遞至耳蝸毛細胞,為因OTOF基因突變導致的先天性深度聽力損失患者提供持久的生理性聽力。此前,DB-OTO已獲得了FDA的孤兒藥資格、罕見兒科疾病認定、快速通道資格和再生醫學先進療法認定,以及歐洲藥品管理局授予的孤兒藥資格。
截至目前,該試驗中已有12名10個月至16歲的患兒接受了DB-OTO治療,其中9人單耳接受了耳蝸內注射,3人雙耳接受了注射。在11名接受治療后療效可評估的患兒中,10人表現出顯著的聽力改善。在接受24周評估的5名患兒中,3人的平均聽力閾值改善至接近正常或正常水平。首例在10個月大時就接受治療的患兒在治療后48周時,聽力改善已接近正常水平,尤其是關鍵的語音相關頻率范圍內的聽力水平。該患兒的語言感知測試結果從第48周到第72周表現出進一步的改善,孩子已能夠在對話中正確識別出“媽媽”、“餅干”和“飛機”等詞語,且無需任何視覺提示。
安全性方面,在所有12名受試者中,手術和DB-OTO均表現出良好的耐受性,未發生與DB-OTO相關的不良事件或嚴重不良事件。5名患者經歷了短暫的手術后前庭不良事件(如眼球震顫、惡心、頭暈、嘔吐),這些癥狀在給藥后6天內消失。
rAAV8.hRKp.AIPL1:公布首個人體臨床試驗結果
MeiraGTx公司宣布,其在研基因療法rAAV8.hRKp.AIPL1用于治療AIPL1相關嚴重視網膜營養不良的首個人體臨床試驗結果在《柳葉刀》期刊上發表。由AIPL1基因缺陷導致的視網膜營養不良會從出生起嚴重影響視力。rAAV8.hRKp.AIPL1利用重組腺相關病毒載體,遞送由人類視紫紅質激酶啟動子調控的人類AIPL1轉基因。
該論文報告了首批單眼接受rAAV8.hRKp.AIPL1治療的4名兒童的相關數據。接受治療前,他們的雙眼視力僅限于對光的感知。接受治療平均3.5年后,其治療眼的視力平均改善至LogMAR評分0.9,而未治療眼在最終隨訪時的視力無法測量。LogMAR是檢測視力的評分系統,數值變小說明視力改善。正常視力的LogMAR評分為0,而干預前患者的LogMAR為2.7。另外,還有7名患有LCA4的兒童雙眼接受了治療。所有11名先天失明兒童的治療眼均獲得了視力改善。
Versamune HPV、PDS01ADC:公布1/2期聯合治療試驗數據
PDS Biotechnology公司宣布,其HPV16靶向免疫療法Versamune HPV、IL-2融合抗體偶聯藥物(ADC)PDS01ADC聯用PD-L1免疫檢查點抑制劑(ICI)的臨床研究結果已發表在JAMA Oncology上。這項由美國國家癌癥研究所(NCI)領導的臨床試驗評估了該三聯療法在復發性/轉移性HPV相關癌癥(包括肛門癌、宮頸癌、頭頸癌等)患者中的療效。
此次公布的試驗結果顯示,該三聯療法在HPV16陽性患者中表現出顯著的臨床效益。在14名未接受過ICI治療的患者中,中位OS達到42.4個月,高于歷史結果的7-12個月。在8名未接受過ICI治療的HPV16陽性患者中,中位OS尚未達到。在ICI耐藥的患者中,中位OS為17個月,優于歷史結果的3-4個月。此外,未接受過ICI治療的HPV16陽性患者的客觀緩解率(ORR)達75%,歷史上發表的結果為11-24%。
LTZ-301:IND申請獲得FDA許可
LTZ Therapeutics公司宣布美國FDA已批準其LTZ-301的IND申請,初步研究將在無標準療法可用或標準治療失敗的復發/難治性非霍奇金淋巴瘤(r/r NHL)患者中進行。LTZ-301是一種新型的髓系細胞接合雙特異性抗體,通過增強Fcγ受體(FcγR)非依賴性抗體依賴性細胞吞噬作用(ADCP)來清除CD79b陽性B細胞。CD79b是一種獨特的腫瘤抗原受體,在B細胞惡性腫瘤中高度表達,包括接受現有CD19或CD20靶向療法治療后復發或耐藥的腫瘤細胞。LTZ-301通過將單核細胞和巨噬細胞重新定向至CD79b陽性B細胞,從而增強這些免疫細胞的吞噬作用并清除癌細胞。臨床前研究表明,LTZ-301在體外和體內實驗中均表現出強效的藥理活性,并具有良好的安全性。
ADCE-T02:IND申請獲得FDA許可
Adcendo公司宣布,美國FDA已批準ADCE-T02的IND申請,可在晚期實體瘤患者中開展1期臨床試驗。組織因子(TF)在膀胱癌、非小細胞肺癌、結直腸癌、宮頸癌、食管癌、頭頸癌和胃腸道癌等過度表達,但在正常組織中表達受限,因此是表現優異的ADC靶點。ADCE-T02是一種新型、高度差異化的TF靶向ADC,其獨特的抗體設計能夠減弱對凝血通路的影響。同時,T1000-exatecan連接子-有效載荷技術平臺經研究證明,能夠放大“旁觀者效應”、提高連接子穩定性,并具備克服耐藥性機制的潛力。這些差異化的特性有望轉化為更高的臨床治療應答率、更長的療效持續時間以及更好的安全性,擁有更優異的治療窗口。2024年8月,Adcendo與普眾發現達成超10億美元的許可協議,獲得在大中華區以外ADCE-T02的全球獨家開發和商業化權利。
四川省醫藥保化品質量管理協會組織召開
2025版《中國藥典》將于2025年10月..關于舉辦四川省藥品生產企業擬新任質量
各相關企業: 新修訂的《中華人..四川省醫藥保化品質量管理協會召開第七
四川省醫藥保化品質量管理協會第七..“兩新聯萬家,黨建助振興”甘孜行活動
為深入貫徹落實省委兩新工委、省市..學習傳達中央八項規定精神專題會議
2025年4月22日,協會黨支部組織召..關于收取2025年度會費的通知
各會員單位: 在過去的一年里,..四川省應對新型冠狀病毒肺炎疫情應急指
四川省應對新型冠狀病毒肺炎疫情應..四川省應對新型冠狀病毒肺炎疫情應急指
四川省應對新型冠狀病毒肺炎疫情應..