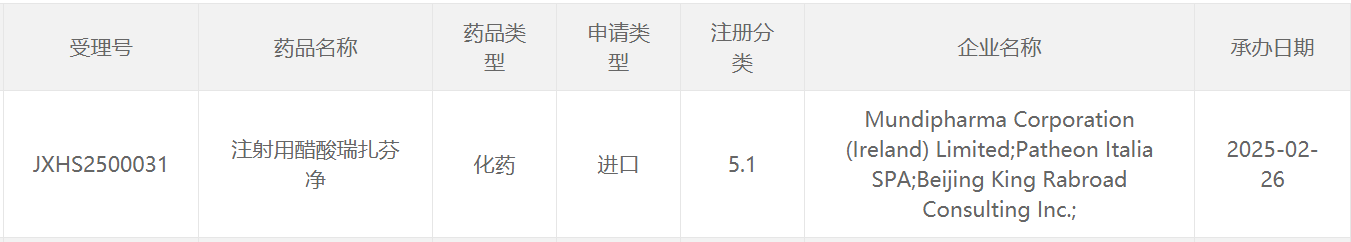
截圖來源:CDE官網
念珠菌是一種酵母菌,經常寄生于皮膚、口腔、消化道與陰道中,通常并不致病,但在某些情況下可能造成這些部位淺表的感染,尤其在孕婦,罹患糖尿病、癌癥、艾滋病等疾病的病患,以及服用抗生素的患者中更為常見。念珠菌感染很少有生命危險,但侵襲性念珠菌病除外。侵襲性念珠菌病主要發生于免疫功能低下與住院患者間,是最常見的醫院獲得性感染之一。而念珠菌血癥則是侵襲性念珠菌最常見的形式,是一種嚴重的血流感染,經常發生在進行大手術或使用靜脈導管與某些抗生素的患者中,若不經及時治療,可能會造成生命危險。
瑞扎芬凈是一種創新、一周一次的棘球白素(echinocandin),用以治療與避免嚴重性的真菌感染,例如念珠菌血癥與侵襲性念珠菌病。公開資料顯示,該產品通過抑制β-1,3-D-葡聚糖合成酶,進而抑制真菌細胞壁的合成從而發揮抗真菌作用。從結構上來看,該產品是由阿尼芬凈衍生而來的一種帶有親脂性尾巴的環狀六肽,與其它棘白菌素相比,在C5鳥氨酸位置的膽堿結構增加了其在體外和體內的穩定性,從而可能增加治療的療效與安全性。
根據公開資料,瑞扎芬凈最初由Cidara Therapeutics開發,萌蒂制藥此前通過合作擁有rezafungin在美國和日本以外的商業權利。2024年4月,Cidara Therapeutics宣布將rezafungin的所有權利剝離給萌蒂制藥。
瑞扎芬凈此前已經獲得美國FDA授予快速通道資格與合格傳染病產品資格(QIDP),并于美國與歐洲獲得孤兒藥資格用以治療侵襲性念珠菌病。2023年3月,FDA批準該產品上市,用于治療沒有替代治療選擇或選擇有限的念珠菌血癥與侵襲性念珠菌病。這一批準是根據全球性ReSTORE臨床3期試驗與STRIVE臨床2期試驗結果。數據分析顯示,與現有必須每天進行注射的標準療法藥物相較,一周一次給藥的瑞扎芬凈達到非劣效性。此結果達成美國FDA與歐洲藥品管理局(EMA)的主要終點標準。2023年12月,該產品于歐盟獲批上市。
根據中國藥物臨床試驗登記與信息公示平臺官網,研究人員在中國也已經完成一項瑞扎芬凈的國際多中心(含中國)3期臨床研究,針對適應癥為念珠菌血癥和/或侵襲性念珠菌病。
本次這款創新產品在中國申報上市,意味著其在中國的注冊進程迎來重要進展。
四川省醫藥保化品質量管理協會組織召開
2025版《中國藥典》將于2025年10月..關于舉辦四川省藥品生產企業擬新任質量
各相關企業: 新修訂的《中華人..四川省醫藥保化品質量管理協會召開第七
四川省醫藥保化品質量管理協會第七..“兩新聯萬家,黨建助振興”甘孜行活動
為深入貫徹落實省委兩新工委、省市..學習傳達中央八項規定精神專題會議
2025年4月22日,協會黨支部組織召..關于收取2025年度會費的通知
各會員單位: 在過去的一年里,..四川省應對新型冠狀病毒肺炎疫情應急指
四川省應對新型冠狀病毒肺炎疫情應..四川省應對新型冠狀病毒肺炎疫情應急指
四川省應對新型冠狀病毒肺炎疫情應..