強生宣布同類首創用于治療復發或難治性多發性骨髓瘤的雙特異性抗體拓立珂® (塔奎妥單抗注射液) 在華獲批
2月11日,強生公司(Johnson & Johnson)宣布塔奎妥單抗注射液(talquetamab)已經獲得中國國家藥監局(NMPA)上市批準。此次獲批的適應癥為:單藥適用于既往接受過至少三線治療(包括一種蛋白酶體抑制劑、一種免疫調節劑和一種抗CD38抗體)的復發或難治性多發性骨髓瘤(RRMM)成人患者。塔奎妥單抗是一款皮下注射的“first-in-class”GPRC5D×CD3雙抗雙特異性抗體,已經在美國和歐洲獲批治療復發或難治性多發性骨髓瘤。塔奎妥單抗(talquetamab)作為一款雙特異性抗體,它可結合T細胞表面表達的CD3受體和GPRC5D。GPRC5D是一種新型多發性骨髓瘤靶標,在多發性骨髓瘤細胞和非惡性漿細胞以及一些健康組織如皮膚和舌上皮細胞表面高度表達。靶向GPRC5D已被證明可提供深度應答,并且與許多其他靶點不同,其表達僅限于免疫細胞,這為靶向這種異質性疾病提供了新方法。早前,talquetamab曾獲美國FDA授予突破性療法認定、孤兒藥資格,并在之后獲得加速批準。2023年8月,FDA加速批準talquetamab用于既往接受過至少4種以上前期療法(包括蛋白酶體抑制劑、免疫調節劑和抗CD38抗體)的復發或難治性多發性骨髓瘤成人患者的治療。同月,強生宣布歐盟委員會有條件批準talquetamab用于治療復發和難治多發性骨髓瘤成人患者,這些患者先前接受過至少3種治療,包括免疫調節劑、蛋白酶體抑制劑和抗CD38抗體,并且在最后一種治療中顯示出疾病進展。在中國,talquetamab的新藥上市申請于2024年初獲NMPA藥品審評中心(CDE)受理,隨后被納入優先審評,適應癥為:單藥治療既往接受過至少三種治療的復發或難治性多發性骨髓瘤成人患者。此前,該新藥同樣被CDE納入突破性治療品種。
強生宣布銳珂®(埃萬妥單抗注射液)在華獲批,一線治療EGFR 20號外顯子插入突變的局部晚期或轉移性非小細胞肺癌患者
2月11日,強生公司宣布,旗下創新治療藥物銳珂®(埃萬妥單抗注射液)正式獲得國家藥品監督管理局批準,與卡鉑和培美曲塞聯合給藥,用于經檢測確認攜帶表皮生長因子受體(EGFR)20號外顯子插入突變的局部晚期或轉移性非小細胞肺癌(NSCLC)成人患者的一線治療。此次獲批標志著強生在華正式進軍肺癌治療領域,有望重新定義治療標準、開創肺癌治療的新時代。此次埃萬妥單抗的獲批是基于一項隨機、開放標簽、PAPILLON臨床Ⅲ期研究結果。該研究表明,與單獨化療相比,埃萬妥單抗聯合化療可將疾病進展或死亡風險降低61%。基于PAPILLON臨床試驗結果,美國國家綜合癌癥網絡(NCCN)《NCCN臨床實踐指南》推薦埃萬妥單抗聯合化療作為EGFR 20號外顯子插入突變非小細胞肺癌患者的首選一線治療方案。
科倫博泰「西妥昔單抗」生物類似藥獲批上市
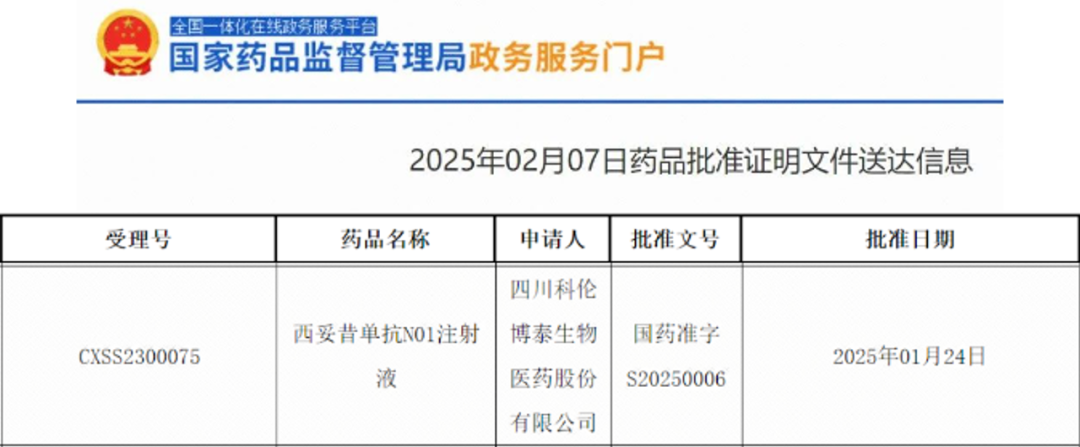
2月7日,國家藥品監督管理局(NMPA)官網發布消息,科倫博泰生物類似藥EGFR單抗西妥昔單抗N01注射液(A140)上市申請獲批,在生物醫藥領域引發關注,這標志著科倫博泰創新藥物研發取得進展,也為癌癥患者帶來新希望。西妥昔單抗是經典抗癌藥,用于治療RAS基因野生型的轉移性結直腸癌和頭頸部鱗狀細胞癌。
西妥昔單抗主要用于治療RAS基因野生型的轉移性結直腸癌以及頭頸部鱗狀細胞癌。在轉移性結直腸癌的治療中,它的表現尤為出色。例如,在CRYSTAL研究中,西妥昔單抗與伊立替康(FOLFIRI)方案聯合用于一線治療,展現出了驚人的效果。對于RAS基因野生型的患者,聯合組的中位無進展生存期(PFS)達到了9.9個月,而FOLFIRI組僅為8.7個月;聯合組的中位總生存期(OS)更是高達24.9個月,相比FOLFIRI組的21.0個月,有了顯著的延長。這意味著,使用西妥昔單抗聯合化療方案,患者的腫瘤進展風險降低,生存時間得到了有效延長。
在頭頸部鱗狀細胞癌的治療中,西妥昔單抗同樣發揮著重要作用。與鉑類和氟尿嘧啶化療聯合用于一線治療復發和/或轉移性疾病,以及與放療聯合用于治療局部晚期疾病,都能顯著提高患者的治療效果和生存質量。
