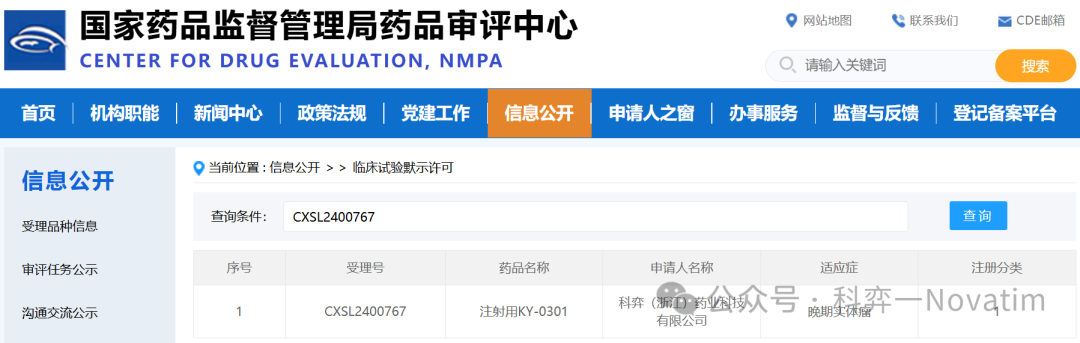
1月16日,科弈(浙江)藥業(yè)科技有限公司(以下簡稱“科弈藥業(yè)”)宣布其從頭自主研發(fā)的全球首個納米雙抗ADC—KY-0301繼2024年12月已獲得FDA臨床試驗批準之后,再獲中國國家藥品監(jiān)督管理局(NMPA)藥品審評中心(CDE)臨床試驗默示許可。
KY-0301是科弈藥業(yè)基于自主創(chuàng)新的納米雙抗ADC平臺“TPEBEN”研發(fā)的全球首個納米雙抗ADC。通過同時靶向細胞間質(zhì)上皮轉(zhuǎn)化因子(c-MET)和表皮生長因子受體(EGFR),開發(fā)雙特異性納米抗體-藥物偶聯(lián)物(BsNb-ADC),可以更有效地將藥物遞送到腫瘤組織并解決藥物在血液系統(tǒng)中過多停留引起的毒性,疊加原創(chuàng)獨到的安全性設(shè)計,從而使得藥物安全性要遠高于目前市面上同類雙抗ADC產(chǎn)品。同時系統(tǒng)性針對納米雙抗ADC工藝進行獨到的優(yōu)化,解決產(chǎn)物均一性問題,將DAR4產(chǎn)物純度提升至行業(yè)最高水平(98%)。在臨床前研究中,KY-0301相比傳統(tǒng)雙抗ADC展現(xiàn)出更有效的腫瘤組織穿透性、更高的抗腫瘤活性和更優(yōu)的安全性。4種CDX動物模型和2種PDX動物模型實驗結(jié)果均顯示,KY-0301能夠快速抑制多種實體腫瘤的生長且?guī)缀醵歼_到完全消退狀態(tài),且在同樣的時間內(nèi)觀察到比傳統(tǒng)雙抗ADC幾乎翻倍的藥物遞送能力。其毒理數(shù)據(jù)也展示了比傳統(tǒng)雙抗ADC更優(yōu)的安全性結(jié)果,這些積極的數(shù)據(jù)為其臨床研究奠定了堅實基礎(chǔ)。科弈(浙江)藥業(yè)科技有限公司成立于2018年,專注腫瘤免疫治療創(chuàng)新藥研發(fā)和臨床應用的生物醫(yī)藥科技型企業(yè),基于臨床需求及差異化出發(fā),致力于通過高效與突破性的研發(fā)創(chuàng)新,布局三大研發(fā)平臺:雙功能抗體平臺、納米雙抗ADC平臺、增強型雙靶CAR-T平臺。從頭自主研發(fā)10余條新穎、差異化的潛在FIC/BIC管線。基于雙功能抗體平臺,公司自主研發(fā)國內(nèi)首個βγ偏向的PD1/IL2融合蛋白,目前單藥/聯(lián)合PD-L1單抗處于中國臨床Phase Ⅰb,美國也均獲得IND批件;基于納米雙抗ADC平臺,公司自主研發(fā)全球首個納米雙抗ADC,中美均獲得IND批件;基于增強型雙靶CAR-T平臺,公司自主研發(fā)全球首個并聯(lián)增強型結(jié)構(gòu)雙靶CAR-T,現(xiàn)處于臨床PhaseⅠ/Ⅱa。